細胞外小胞(EV)の蛍光ラベル

細胞外小胞(EV)の可視化とトラッキングのための標識について
in vitro では、EV の取り込みは、通常顕微鏡またはフローサイトメトリーを使用して測定され、ラベリングの種類として蛍光が選択されます。in vivo 研究では、蛍光が多い傾向にありますが、生物発光や放射線(RI)が使用されることもあります。生物発光は、生物発光可能なタンパク質に結合した EV マーカーの配列を EV ドナー細胞にトランスフェクトすることによって一般的に使用されます。1
生物発光の利点は、蛍光標識よりも光退色が起こりにくく、より安定しています。ただし、ドナー細胞の遺伝子改変が必要なため、生物発光標識では特定のタンパク質を含む EV のみを標識できます。
EV には特異的なするマーカーがないため生物発光を使用すると選択的なラベリングが行われます。EV に RI ラベルを付けることはまれですが、それは、安全性への懸念と、その結果生じる動物実験の規制の複雑さによるものと思われます。2
これらすべての事項を考慮すると、EV のラベル付けには、昔ながらの蛍光が最も一般的な選択肢です。しかし、ここでは蛍光標識とその課題について説明しています。
細胞外小胞(EV)の蛍光標識に注目
どのような種類の蛍光標識でも、細胞、組織、溶液の自家蛍光によって妨げられ、高レベルのバックグラウンドノイズが発生する可能性があります。さらに、蛍光マーカーは光退色して使用できなくなる傾向があり、多くの用途で問題となります。ラベル強度が弱い場合、より長い露光時間が必要となるため、この問題はさらに悪化し、光退色リスクがさらに高まります。
さらに、組織透過性が低いため、蛍光が in vivo での応用に適さないか、感度が低くなり、取り込みの局在を特定するためにex vivo 臓器摘出が必要になることがよくあります。これらの大きな欠点にもかかわらず、蛍光は依然として EV のラベリングに選択される方法です。これはおそらく、蛍光が馴染みがあり、検出用の機器が入手可能であるためと考えられます。
脂溶性色素
最も一般的に使用される EV 標識は、脂溶性蛍光色素です。化学構造の違いにもかかわらず、すべての脂溶性色素は互いに同様に機能し、その疎水性のおかげで EV の脂質二重膜に挿入されます。脂溶性色素で EV を標識するためのプロトコルは簡単です。必要な濃度の色素を EV と混合し、必要な温度で、時間インキュベートします。過剰な色素は、EV 除去ウシ胎児血清 (FBS) またはウシ血清アルブミン (BSA) の添加によって除きます。
非親油性色素
非親油性蛍光色素には、F-アクチンを標識や 3 および CFSE (管腔内アミンを標識する) 4 があります。
しかし、異なるEV(例えば、異なるサブタイプまたは起源の細胞)は異なるF-アクチンまたは管腔内アミンレベルを有する可能性があると合理的に想定できるため、これらの標識方法は、本質的に変動しやすく偏りがあると予想される親油性マーカーよりも大きくなります。すべての EV を均等にラベルします。
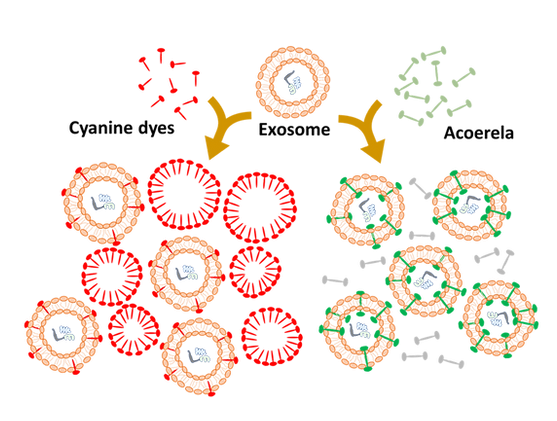
バックグラウンドを生じない新しい色素「脂質膜蛍光ラベリングキット(ACOERELA/アコエレラ)」

ACOERELA膜資質蛍光ラベリングキットは色素自体からのアーティファクトや偽陽性シグナルを発生させることなく、ナノサイズの細胞外小胞を正確に検出できます。これは、色素が水溶性でありミセルやナノ粒子に自己集合するのを防ぐ、ACOERELA色素の独自の特許取得済みの化学反応によるものです。

主な特長
- 水溶性 (>2 mg/mL 溶解度)
- 安定した標識 (>24 時間)
- 小胞間の色素交換はありません
- 短いインキュベーション時間 (約 30 ~ 60 分)
- さまざまな色をご用意しております
特定のタンパク質標識
細胞外小胞(EV)の特定のタンパク質をラベルするには、細胞株または生物の遺伝子改変による緑色蛍光タンパク質 (GFP) または類似の蛍光タンパク質 (mCherry など) と融合したタンパク質や蛍光ラベルした抗体が使用できます。通常は CD9、CD63、CD81 などのテトラスパニンを標識使用します。
ただし、Han et al (2021) による研究では、これら 3 つのテトラスパニンはいずれも、調査した 3 つの細胞型のいずれのすべての EV (またはほぼすべて) にも見つからないことがわかりました。5 これを視覚化した図 1 でわかるように、すべての EV にテトラスパニンが標識されていないだけでなく、異なるセルからの EV のテトラスパニンの状況は大きく異なります。これは、EV マーカーベースのラベルではすべての EV にラベルを付けることができないだけでなく、ラベル付けに偏りが生じる可能性が高いことを意味します。

遊離色素除去
遊離色素はバックグラウンドになったり、ミセルを形成し、タンパク質と結合しさらに大きな凝集体を形成されることが示されています。(図2. 6 7)
何らかの形で除去されることが試みられてきたケースで、脱塩カラムを使用して余分な色素を除去する前に、できる限り多くの色素を吸収するために、BSA (生物学者が好む粘着性のあるタンパク質) の形でタンパク質を加えます。10 しかし、超遠心分離が多く使われています。超遠心分離法を使用すると、EV と過剰な色素の溶液が EV のペレット化して遠心分離されます。6 脱塩カラムは、微量の遊離染料汚染物質を除去しただけで、より大きなミセルとタンパク質が存在したままになることが多いです。
タンパク質関連色素を処理するには、サイズ排除クロマトグラフィー (サイズ排除クロマトグラフィー:SEC) を使用できます。この方法は過剰な色素の大部分を除去することが示されています。9 当社の qEV カラム(SECカラム)は、過剰な色素の除去に使用され、成功しています。11,12
ただし、単一の技術の場合と同様に、 SEC 9 後に少量の過剰な色素が残ります。これは、異なる種類の汚染染料粒子が EV と同じサイズまたは密度を持つ可能性があるためです。これは、すべての汚染色素粒子を除去するには、qEV カラムなどのサイズベースの技術と密度勾配超遠心分離6などの密度ベースの技術を組み合わせることが最善の方法です。どちらの方法を使用する場合でも、EV ソリューションの代わりにバッファーを使用する色素のみのコントロールを作成することが重要ですが、それ以外は同じように扱われます。このようにして、非特異的な色素の取り込みを定量化し説明することができます。
EVラベリングの未来
EV の取り込みを研究するために EV にラベルを付けることの重要性は高く、より多くの EV試薬が市場に投入されるにつれて、その重要性はさらに高まる可能性があります。
ラベル貼り付けの効率とクリーンさを向上させることが不可欠です。qEV カラム、脂質膜蛍光ラベリングキット(ACOERELA)は、この問題解決に不可欠な製品です。
参考文献
- Wu, A. Y. et al.
Multiresolution Imaging Using Bioluminescence Resonance Energy Transfer Identifies Distinct Biodistribution Profiles of Extracellular Vesicles and Exomeres with Redirected Tropism. Adv Sci (Weinh) 7, 2001467 (2020).
https://doi.org/10.1002/advs.202001467 - Hong, C. M. et al.
Radioiodine labeling and in vivo trafficking of extracellular vesicles. Sci Rep 11, 5041 (2021).
https://doi.org/10.1038/s41598-021-84636-5 - Kruse, T., Schneider, S., Reger, L. N., Kampmann, M. & Reif, O. W.
A novel approach for enumeration of extracellular vesicles from crude and purified cell culture samples. Eng Life Sci 22, 334-343 (2022).
https://doi.org/10.1002/elsc.202100149 - Morales-Kastresana, A. et al.
Labeling Extracellular Vesicles for Nanoscale Flow Cytometry. Sci Rep 7, 1878 (2017).
https://doi.org/10.1038/s41598-017-01731-2 - Han, C. et al.
Single-vesicle imaging and co-localization analysis for tetraspanin profiling of individual extracellular vesicles. J Extracell Vesicles 10, e12047 (2021).
https://doi.org/10.1002/jev2.12047 - Dominkus, P. P. et al.
PKH26 labeling of extracellular vesicles: Characterization and cellular internalization of contaminating PKH26 nanoparticles. Biochimica Et Biophysica Acta-Biomembranes 1860, 1350-1361 (2018).
https://doi.org/10.1016/j.bbamem.2018.03.013 - Takov, K., Yellon, D. M. & Davidson, S. M.
Confounding factors in vesicle uptake studies using fluorescent lipophilic membrane dyes. J Extracell Vesicles 6, 1388731 (2017).
https://doi.org/10.1080/20013078.2017.1388731 - Vogel, S. M., Minshall, R. D., Pilipović, M., Tiruppathi, C. & Malik, A. B.
Albumin uptake and transcytosis in endothelial cells in vivo induced by albumin-binding protein. Am J Physiol Lung Cell Mol Physiol 281, L1512-1522 (2001).
https://doi.org/10.1152/ajplung.2001.281.6.L1512 - Melling, G. E. et al.
Confocal microscopy analysis reveals that only a small proportion of extracellular vesicles are successfully labelled with commonly utilised staining methods. Sci Rep 12, 262 (2022).
https://doi.org/10.1038/s41598-021-04225-4 - Timms, K. et al.
Watermelon-Derived Extracellular Vesicles Influence Human Ex Vivo Placental Cell Behavior by Altering Intestinal Secretions. Molecular Nutrition & Food Research 66 (2022).
https://doi.org/10.1002/mnfr.202200013 - Sariano, P. A. et al.
Convection and extracellular matrix binding control interstitial transport of extracellular vesicles. J Extracell Vesicles 12, e12323 (2023).
https://doi.org/10.1002/jev2.12323 - Fortunato, D. et al.
Selective isolation of extracellular vesicles from minimally processed human plasma as a translational strategy for liquid biopsies. Biomark Res 10, 57 (2022).
https://doi.org/10.1186/s40364-022-00404-1
関連製品