ナノ粒子マルチアナライザー(Exoid)

1粒子毎のゼータ電位・粒子径を同時測定
Exoid(TRPS)は他の手法と比較して、正確・信頼性の高いゼータ電位測定が可能
レーザードップラー流速測定に基づくアンサンブル技術である、位相分析光散乱 (PALS) は、ナノ粒子懸濁液のゼータ電位を測定するための最もよく知られた技術ですが、粒子の平均移動度を測定および計算することしかできないため、特に多分散サンプルを測定する場合には詳細な単一粒子情報が失われます。
Exoidの単一粒子測定技術 TRPS(Tunable Resistive Pulse Sensing)では、粒子サイズとゼータ電位に関する懸濁液中の情報を粒子毎に同時測定し、マルチモーダルで多分散サンプルでも正確な解析ができる、テクノロジーです。
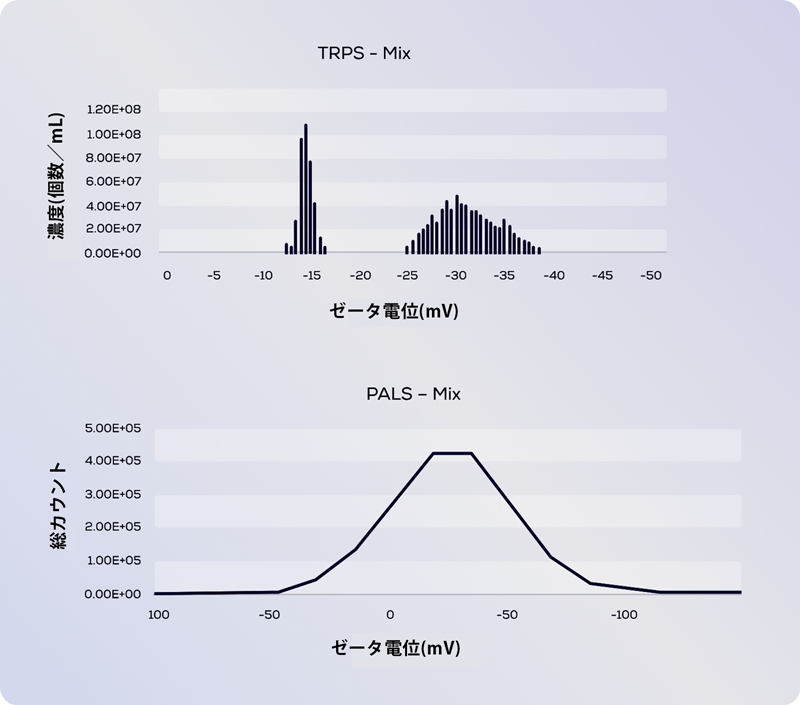
上図は、380 nm の低電荷ポリスチレン粒子と 400 nm の高電荷カルボキシル化ポリスチレン粒子の2種をMIXしたサンプルの Exoid(TRPS) と PALSの比較です。
Exoid(TRPS) は 2 種類の粒子を完全に分離でき (上)、ゼータ電位は混合されていないサンプルからの値とよく一致しますが、PALSは溶液の平均ゼータ電位値 (下) しか測定できません。そのため、両者の測定結果には大きな違いがあります。
EVの次世代特性評価(ExoidによるEV測定事例)
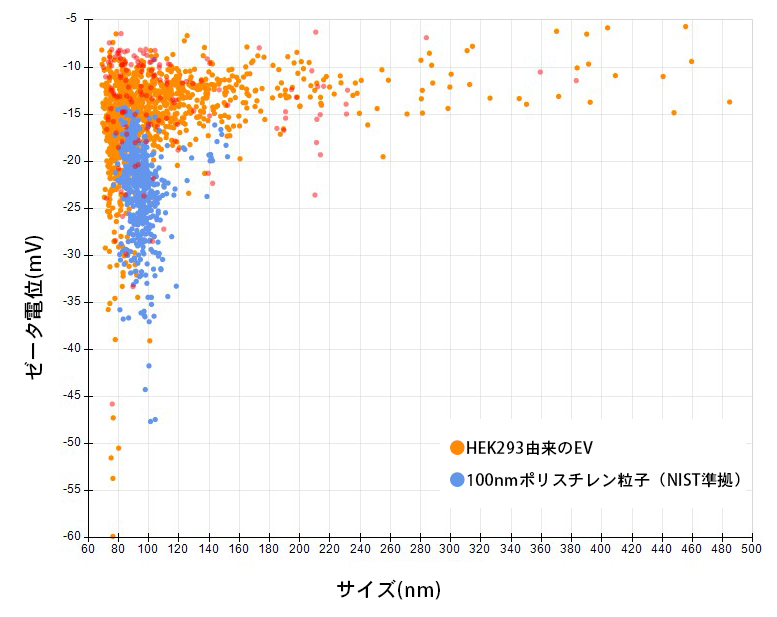
上図は、約100nmポリスチレン粒子とHEK293由来EVのゼータ電位測定結果です。
ポリスチレン粒子は約22mVを中心に分布があり、EVは約15mVを中心に分布が広がっており、粒径とゼータ電位の関係を確認することができます。
EVに関しては、サイズが大きいEVであっても、約15mVのゼータ電位量であることが確認できます。
真のゼータ電位分布により、偏りのない結果が得られます
粒子サイズと表面電荷分布が多分散である場合、レーザードップラー流速測定法やPALS測定での信頼性は非常に低くなります。
一方、Exoid(TRPS)は、単一粒子の電気泳動移動度を個別に測定することができます。
電気泳動移動度は、それらの線形関係によってゼータ電位に変換されることから、サイズ分布による偏りのないゼータ電位が得られ、サイズ VS 電荷プロット、濃度 VS 電荷プロット、または 3D 濃度 VS 電荷/サイズとして測定できます。Exoidで正確なゼータ電位を計測することで、生体分子の特性または活性を特定することができます。
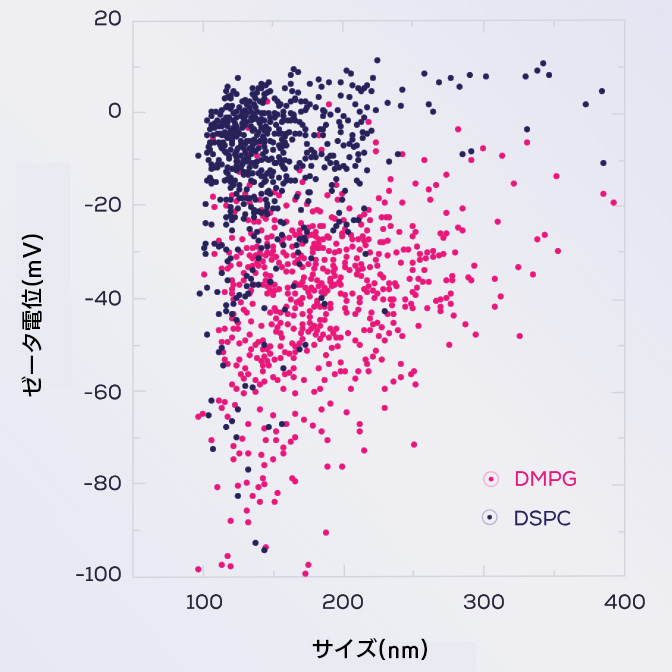
DSPC(1,2-ジステアロイル-sn-グリセロ-3-ホスホコリン)
Exoidは電気抵抗ナノパルス法(TRPS)により、粒子サイズとゼータ電位を粒子毎に同時計測できる装置です。
ナノ粒子の特性は、標的組織・細胞への取り込みへの影響など、生物学的相互作用において中心的な役割を果たします。Exoid(TRPS)での高分解能な単一粒子径とゼータ電位の特性評価により、microRNAの送達における研究や理解を深め、薬剤耐性の克服、がん治療/診断など、多くの治療用途に活用できる可能性があります。
バッファー内生理強度の電荷測定
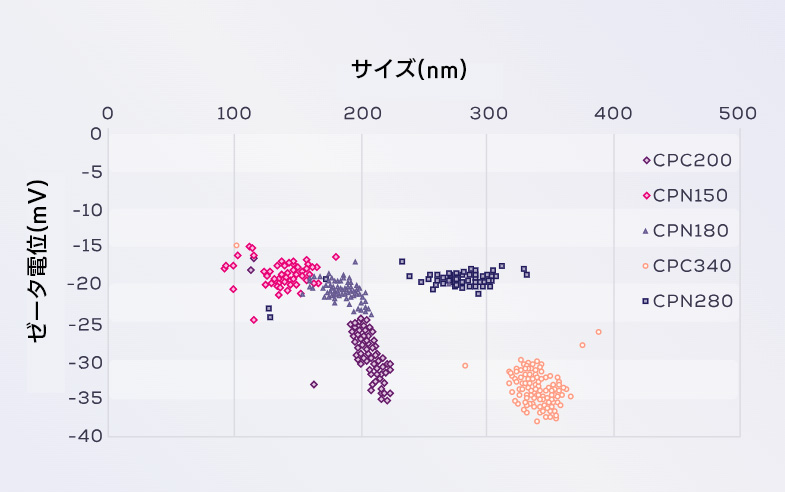
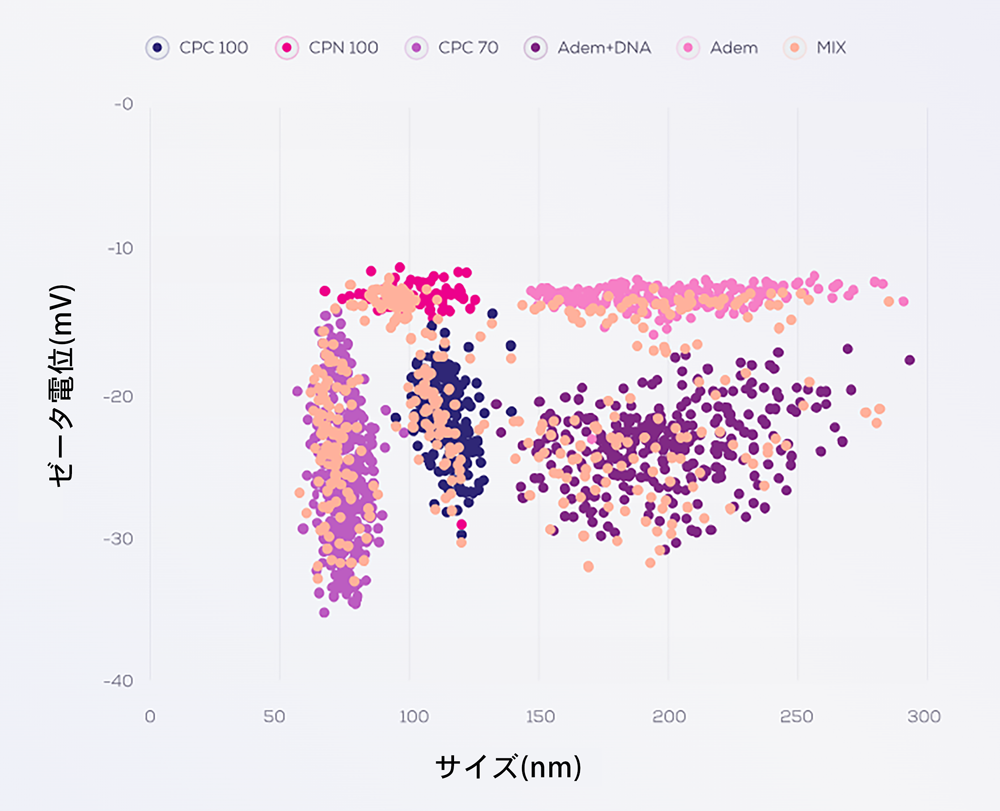
カルボキシル化(CPC)ポリスチレン粒子混合物のExoid(TRPS)によるサイズとゼータ電位の同時測定
粒子の分散および配合は、静電反発、立体障害、またはこれら 2 つの力の組み合わせによって安定化されます。十分な安定化がないと粒子は最終的に凝集します。そのため、粒子の静電的安定性の指標としてゼータ電位を使用します。ゼータ電位は、溶液中の粒子の電気泳動移動度(ms)を測定することによって導出されるモデル化された量です。電気泳動移動度は、粒子と溶液の特性 (イオン強度、イオン組成、粘度) に大きく依存します。したがって、生物学的用途向けに設計された生理的溶液中でナノ粒子またはナノ製剤のゼータ電位分析を実施することが重要です。
高分解能の単一粒子によるゼータ電位分析は、さまざまな pH および溶液条件下での粒子挙動を高度に解析することができ、バイオキネティック研究のために、時間経過に伴う粒子コロナの変化をモニターすることに役立ちます。さらに、粒子の安定性と細胞内への取り込みを決定する上で正確な電荷を計測することは重要です。
最終スケール精度
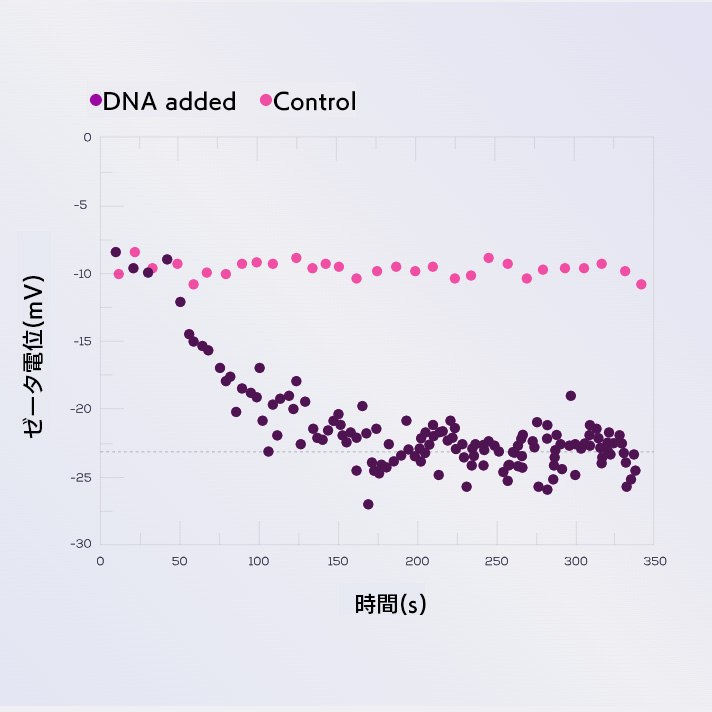
上記は、磁性バイオアデムビーズへのビオチン化DNA反応の動態を、ゼータ電位測定からモニターし、DNA反応の前にバイオアデムビーズ表面のストレプトアビジンを酵素的に切断したコントロールと比較しました。
DNAを流体セルに添加してから約100秒後、ゼータ電位の移動平均(25個の粒子平均)は約-20mVで水平になり、反応の飽和を示しました。コントロールのゼータ電位は時間とともに変化しません。
Exoid(TRPS)で測定したゼータ電位の詳細なマッピングを通して、粒子を区別することができ、膜小胞の膜組成変化に伴う表面電荷の微妙な変化も解明できます。
また、Exoid(TRPS)は、粒子とリガンドの相互作用によるゼータ電位の変化をリアルタイムモニターできます。これは、ストレプトアビジンでコートした粒子表面へのビオチン化一本鎖DNA(35塩基)の結合で実証されています。拡散依存性結合反応は、30秒後にDNAを添加後、約170秒以内に完了し、DNAの結合はゼータ電位の低下と一致しました。
分解能の限界はオリゴ被覆率の10%でした。例えば、DNA/粒子比が400の粒子の場合、分解能の限界は粒子あたり44オリゴでした。プロテイナーゼKで酵素的に不活性化したストレプトアビジンを用いたコントロール反応では、DNAとの相互作用は見られませんでした。また、長いオリゴでは感度が向上します。
Exoid(TRPS)は、様々な粒子間相互作用の電荷研究に利用することが出来ます。
- ゼータ電位に基づくベシクルの特性評価
- キャリア粒子の電荷を変化させるレセプター - リガンド相互作用
- 抗体 - 抗体反応
- アプタマーに基づく検出技術
2つ以上の混在した粒子も、個別にゼータ電位の測定が可能
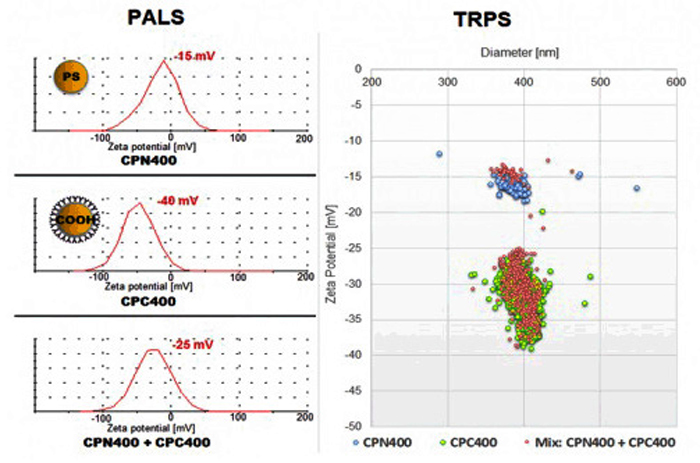
一般的に使用されているζ電位測定のPALS法では個々のζ電位を測定することは出来ない為、問題となっていました。 TRPS法は、個々のゼータ電位を測定することで、問題を解決しました。
上図は、ほぼ中性のPS粒子と、カルボキシル化した粒子、2つの粒子を混ぜた粒子の測定を行いました。
PALS法を使用した測定では、PS粒子では-15mV、カルボキシル化した粒子で-40mVと データが測定出来ていますが、両方の粒子を混ぜた粒子では、平均の-25mVと出てしまっています。
TRPS法ではPS粒子は-15mVに、カルボキシル化した粒子では-25mVから-40mVで粒子が検出されおり、PALS法と比べて相関が取れたデータが出ています。
また、2つの粒子を混ぜた測定でも、-15mVと-25mV~-40mV周辺で個別で測定したデータと同じデータが出ています。
複数の粒子が混在していても個別の粒径とζ電位が測定できるのはTRPS法を採用しているExoidのみで行える測定です。
1粒子からの表面電荷量測定
従来のDLS技術を利用した表面電位計測装置では、全分布の平均表面電荷量の計測しか出来ませんでした。ExoidはTRPS技術により、粒子1つの表面電荷を計測することができ、従来のDLS技術と相関を持った表面電荷量計測(左表)と同時に粒子1つ1つの表面電位量も計測することも可能となりました。(左図)
疾病由来の細胞外小胞を定量
Exoidでは抗体を使用して計測した生体粒子の特定や抗体の評価ができます
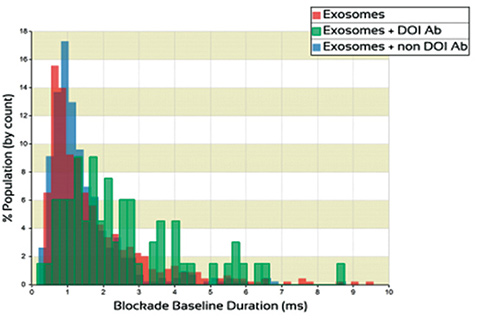
左のグラフの ■で示したグラフは抗体が細胞外小胞に結合することで、細胞外小胞の表面チャージ量が変化し、ナノポアの通過時間が遅くなっていることを示しています。
細胞外小胞のみ(■)と細胞外小胞に非特異的な抗体を混ぜて、計測したサンプル(■)と比較してもナノポアの通過時間が遅くなっています。
回収された粒子が疾病由来の細胞外小胞であることが確認できます。
測定原理は、電気抵抗ナノパルス法(TRPS)
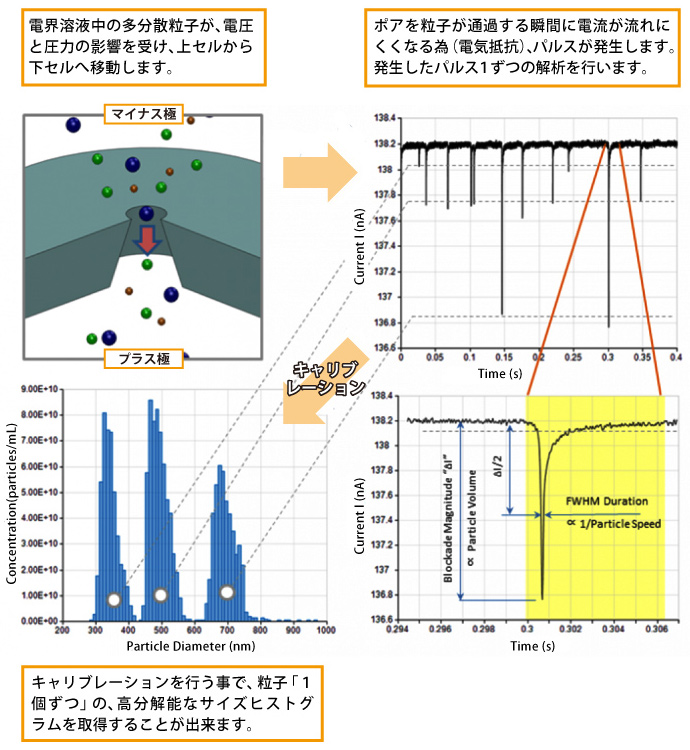
ナノポアを挟んだ溶液中に電圧をかけると溶液中に含まれるナノ粒子が細孔を通過します。その際、電気抵抗ナノパルスが発生します。
ナノパルスは粒子の体積を示しており、長いパルスほど体積の大きい粒子となります。Exoidでは粒子を「1個ずつ」カウントするため、高分解能なサイズヒストグラムを取得します。
電解溶液中のパルスは毎秒50,000回モニタリングしています。 検出したパルスより下記内容を解析することが出来ます。
① パルスの大きさ → 粒子の体積に比例
② パルスの幅 → 粒子の速度と表面電荷
③ パルスの数 → 粒子の濃度
粒子1つ1つを測定して、高精度な解析を実現
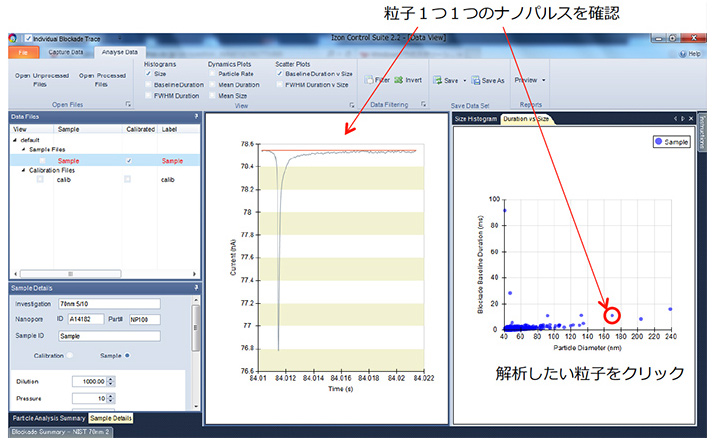
ナノポアを粒子が通過する時間は粒子の表面電荷に関わる一次情報になります。 粒子の通過時間は電流遮断時間、つまりナノパルスの幅を見ることで計測できます。
表面電荷の変化を測定
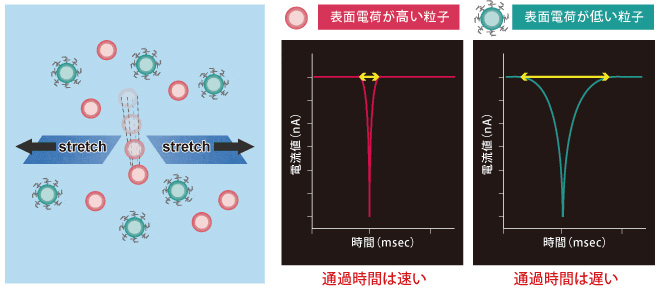
ナノポアを粒子が通過する時間は粒子の表面電荷に関わる一次情報になります。粒子の通過時間は電流遮断時間、つまりナノパルスの幅を見ることで計測できます。
高精度サイズ分布測定
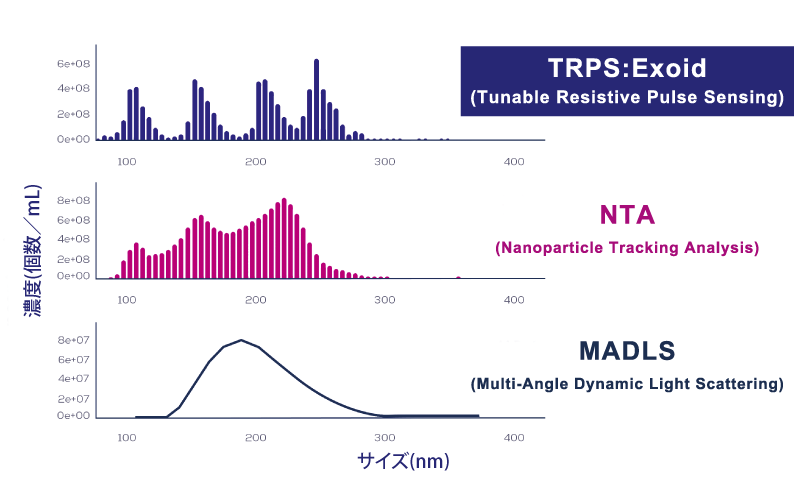
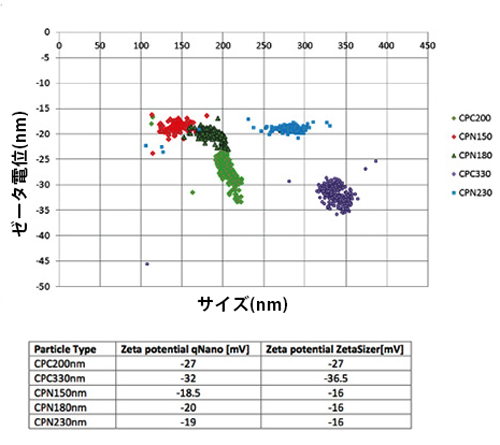
上図は、マルチモーダルな(4種類の粒子を混ぜた)多分散粒子を計測比較した結果です。
Exoidで使用されているTRPSの精度は、特に多分散性のサンプルにおいて、それぞれの粒子を正確にサイズ決定するのに十分な精度を持つ技術です。
Exoidであれば、NTA法やMADLS法で得られなかった真の粒子サイズを得ることができます。

