qEVシリーズ /細胞外小胞抽出キット
GMP対応 qEVカラム 誕生
EV研究や治療用途の進展に伴い、GMP対応qEVカラムが登場しました。
バイオバーデンやエンドトキシンレベルを低減する特別な製造プロセスで作られ、クリーンルームでの生産や
追加の洗浄・無菌製造プロトコルを採用。各バッチには分析証明書が付属し、品質を保証します。
EV治療薬の開発やGMP準拠の環境でEVを扱う研究者に最適です。
医療機器の品質マネジメント国際標準規格ISO 13485 を取得!
ISO規格で保証されたqEV細胞外小胞抽出(EV)キット
※ qEV、AFCは基礎的研究目的で使用願います。臨床、医療行為には使用できません。
GMP対応qEVカラムが登場

GMP対応qEVカラムとは?
EVは、その固有の特性と薬物送達ベクターとしての可能性から、治療薬として魅力的です。
現在までに、米国FDAは哺乳類細胞由来のEV治療薬の承認を取得していませんが、近い将来に承認されると予想されています。
これを受け、qEVカラムをバイオ医薬品分野に提供できるよう積極的に取り組んでいます。
規制遵守と関連するリスク評価の責任を負いますが、GMP 対応カラム製造のために導入された追加対策は、
GMP 環境で作業するお客様にとって良い出発点となります。
細胞外小胞(EV)を15分で分離・精製
カラム内部にはアガロース樹脂のメッシュがあり、そのメッシュの表⾯には無数の⼩さな⽳が開いています。適正抽出サイズより⼤きな粒⼦はメッシュで遮られるため通過が遅れます。また、適正抽出サイズより⼩さな粒⼦はメッシュ表⾯の⽳に⼊るため、通過が遅れます。マニュアル通りのタイミングで回収することで、15分の抽出時間で誰でも簡単に細胞外⼩胞の抽出が⾏えます。
細胞外小胞の研究を加速させるqEV抽出
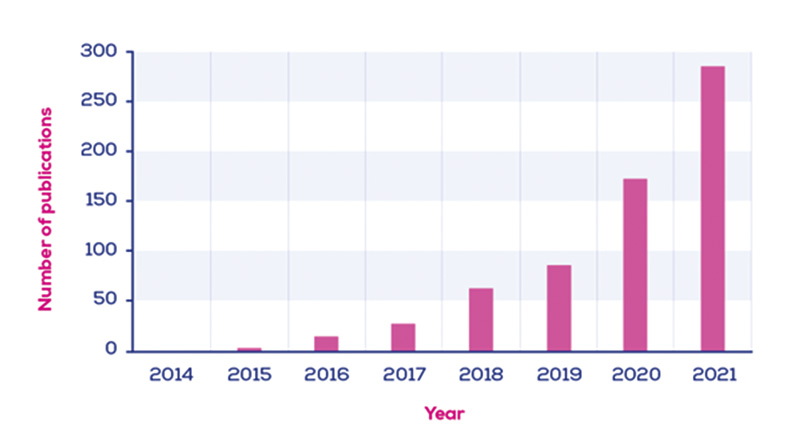
2014 年〜2021年までに公開された⽂献数をまとめたグラフ
qEV カラムは、2015 年~2021 年にかけて650 以上の出版物で使⽤されています。
qEV分離によって可能になった研究の最新情報を⼊⼿するには弊社のニュースレターにご登録ください。定期的に論⽂情報を含む最新情報をお届けいたします。
純粋な細胞外小胞を抽出
qEVカラムは、EV含有サンプルからの可溶性タンパク質の除去に⾮常に効果的です。このことは、EV以外のコンポーネントの共分離がダウンストリーム分析の精度に影響を与え、その後、結果をゆがめる可能性があるため、特に重要です。
qEVは幅広いカラムサイズで可溶性タンパク質からのEVの分離を最⼤化するように最適化されています。qEV Gen2 カラムは、この⾼分解能分離を可能にする独⾃の⾼性能樹脂で構築されています。
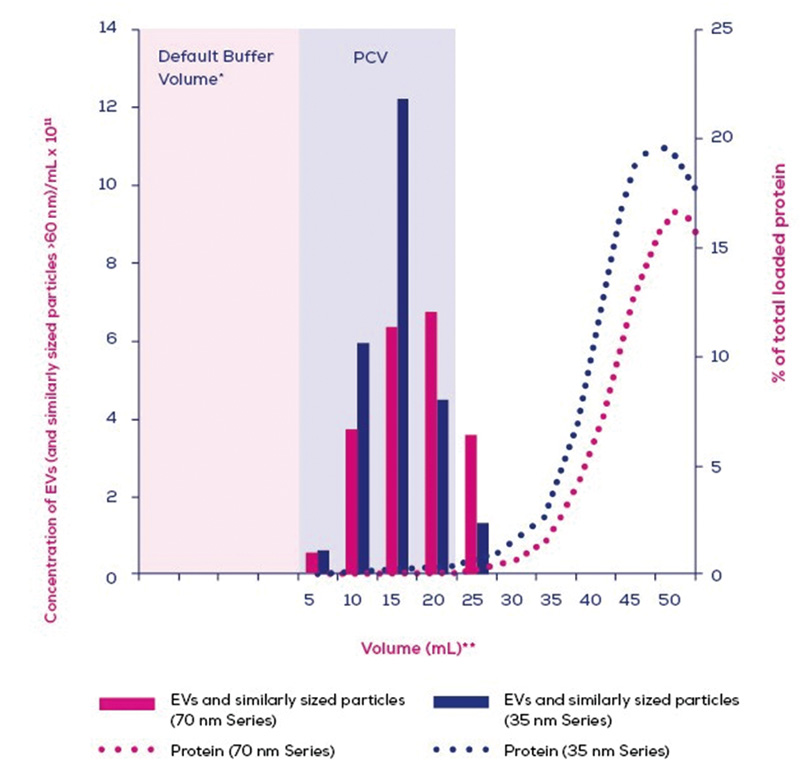
10mLのヒト⾎漿をロードした、qEV 10/35nm (Gen2)とqEV 10 / 70nm (Gen 2 )カラム間の総タンパク質溶出レベルと細胞外⼩胞および同様のサイズの粒⼦>60nmの濃度の⽐較です。EV濃度は、ビシンコニン酸(BCA)アッセイによるExoidおよびタンパク質レベルを使⽤して測定されました。
※注意
qEV10/35nm Gen 2 (23.2mL)カラムと、qEV10 / 70nm Gen 2 (22.9mL)カラムでは、デフォルトのバッファー量の値が異なります。
**容量はそのサンプルの最⼤容量としてラベル付けされています。
ラベル「5」はバッファー容量後の0.0〜5.0mLの容量を指し、ラベル「10」はバッファー容量後の5.0〜10.0mLの容量を指します。
再現性
アプローチを使⽤することで、再現性を向上させます。対照的に、多くのEV分離アプローチは、⼿動の⽅法(例えば、超遠⼼分離(UC)、密度勾配遠⼼分離、および⾃家製のSECカラム)に広く依存しており、これらの⽅法の再現性の低さは広く⽂書化されています。
例えば、EV収量の量的な違いは、UC の機器とオペレーターに依存する、技術的変動の両⽅によるものと考えられています。密度ベースの分離⽅法はUC⾃体に依存しているため、同じ変動源を共有しています。⼀⽅、カラム作成の「DIY」ルートは、⾼度な最適化(およびその後の時間)、リソース、およびスキルを必要とする効率的で標準化されたカラムの作成で、不必要なエラーの可能性をもたらします。
ダウンストリーム分析に合わせてサンプルの組成を調整
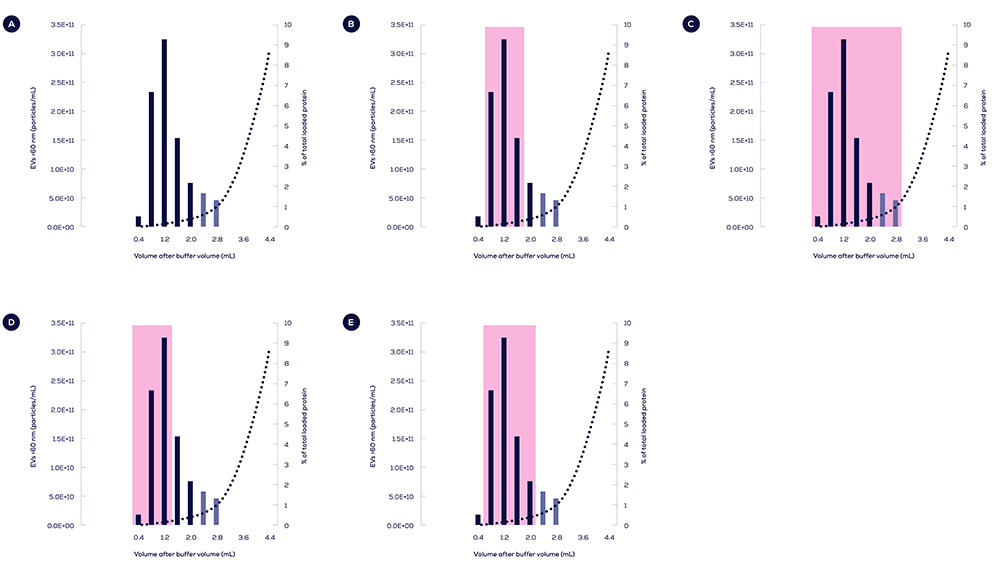
精製された抽出液量(PCV)の純度が高まることには、もう一つの大きなメリットがあります。分離が改善されたことで、より多くのフラクションからEVのみを抽出することができ、新しいレベルのコントロールが可能になりました。以下に示すように、抽出後の分析目的に合わせて、異なるPCVを選択することができます。
(A) Gen 2 qEV original/35 nmカラムとオートフラクションコレクター(AFC)を用いて分離したヒト血漿サンプルの溶出プロファイル。粒子数(バー)はExoidで測定し、タンパク質はビシンコニン酸アッセイで測定した(点線)。色あせたバーは、様々なプールボリュームからの計算と比較に基づく推定細胞外小胞(EV)濃度を示しています。用途や分析方法に応じて、異なる抽出液量(PCV)を選択し、サンプルを最適化することができます。
(B) EV濃度、(C) EV回収率、(D) EV純度のいずれかを優先するために、異なるPCVをプールすることができます。
(E) 推奨されるデフォルト設定では、EVの回収率と純度のバランスを優先します。ユーザーマニュアルには、いつ、どのようにAFCの設定を調整する必要があるかについてのガイダンスが記載されています。
qEV Gen2(第2世代)カラム新登場!
独自開発の樹脂で細胞外小胞 (EV) 純度のさらなる向上を実現
さらに多くの夾雑タンパク質を除去

qEV Gen2カラムに使用されている独自の樹脂は、左図に示すように、ロードされたサンプルからより多くのタンパク質を除去することができます。
上図は、AFC(オートフラクションコレクター)を使用して分離したヒト血漿サンプル(2 mL)に含まれるタンパク質を、アプライされたタンパク質全体に対する割合を示しています。タンパク質はビシンコニン酸アッセイ(BCA)で測定しました。70nmシリーズおよび35nmシリーズのqEV Original Legacy(第1世代)カラムおよびqEV Gen2 Originalカラムのデータを示しています。(0.5mLのローディングボリューム)
細胞外小胞/タンパク質比率向上で真のEVタンパク評価

Tunabl Resistive Pulse Sensing(TRPS法)とビシンコニン酸アッセイ(BCA)でそれぞれ測定したタンパク質1μgあたりの細胞外⼩胞(EV)の数を⽰しています。
上図は、AFC(オートフラクションコレクター)と、70nmおよび35nmシリーズのqEV original カラム(ロードボリューム0.5mL)を⽤いて、分離したヒト⾎漿サンプルについて⽰しています。qEV Gen2 カラムカラムでは分離が強化されているため、より精製されたEV含有サンプルを得ることができます。
マイルド抽出でインタクトEV抽出

超遠⼼機による分離はEVを強い重⼒にさらすため、EVは分解、凝集、融合しやすくなりますが、qEVカラムは穏やかなアプローチを提供します。SECベースのqEVカラムは、無傷で機能的なEVの分離を可能にします。
【関連⽂献】Higher functionality of extracellular vesicles isolated using size-exclusion chromatography compared to ultracentrifugation.
Mol EA, Goumans MJ, Doevendans PA, Sluijter JPG, Vader P.
Nanomedicine:Nanotechnology,Biology and Medicine.
2017;13(6):2061-2065.doi:10. 1016/j.nano.2017.03.011
High-speed centrifugation induces aggregation of extracellular vesicles.
Linares R, Tan S, Gounou C, Arraud N, Brisson AR.
Journal of Extracellular Vesicles.
2015;4(1):29509.doi:10.3402/jev.v4.29509
Gen2 qEV がフルラインナップ
qEV Legacy(第1世代)販売終了のお知らせ(2023年12月11日)
この度、長らくご愛顧いただいておりました【第1世代】qEVシリーズは、後継シリーズへの移行に伴い、販売を終了とさせていただくこととなりました。
つきましては、【第1世代】qEVシリーズをご用命のお客様は、2023年12月25日が最終受注日となりますので、ご注意頂けますようお願い申し上げます。

Gen2 qEV 70シリーズ(抽出サイズ領域 70~1,000 nm)
| Gen2 qEV single /70 | Gen2 qEV original /70 | Gen2 qEV 1 /70 | Gen2 qEV 2 /70 | Gen2 qEV 10 /70 | Gen2 qEV 100 /70 | |
|---|---|---|---|---|---|---|
| サンプル容量 | 150μL | 500μL | 1mL | 2mL | 10mL | 100mL |
| Column Volume | 3.0mL | 8.5mL | 13.5 mL | 45.1 mL | 69.3mL | 600mL |
| フラクションサイズ | 0.17mL | 0.4 mL | 0.7 mL | 2 mL | 5 mL | 50mL |
| 使⽤回数 | 1回 | 5回 | 5回 | 5回 | 5回 | 5回 |
| AFC使⽤ | 可 | 可 | 可 | 可 | 可 | 不可 |
Gen2 qEV 35シリーズ(抽出サイズ領域 35~350 nm)
| Gen2 qEV single /35 | Gen2 qEV original /35 | Gen2 qEV1 /35 | Gen2 qEV2 /35 | Gen2 qEV10 /35 | Gen2 qEV100 /35 | |
|---|---|---|---|---|---|---|
| サンプル容量 | 150μL | 500μL | 1mL | 2mL | 10mL | 100mL |
| Column Volume | 3.0mL | 8.5mL | 13.5 mL | 45.1 mL | 69.3mL | 600mL |
| フラクションサイズ | 0.17mL | 0.4 mL | 0.7 mL | 2 mL | 5 mL | 50mL |
| 使⽤回数 | 1回 | 5回 | 5回 | 5回 | 5回 | 5回 |
| AFC使⽤ | 可 | 可 | 可 | 可 | 可 | 不可 |
qEV 濃縮キット
EV含有サンプルを濃縮するためのシンプルで便利なキットです。qEVで抽出したEVの分析によっては、qEVカラムから抽出後に濃縮ステップが必要になる場合があります。qEV濃縮キットを使⽤すると、EVを含むサンプルをダウンストリーム処理に便利な量に濃縮することができます 。
- qEVで抽出したインタクトなEVを濃縮収集ボリュームの範囲を集中します。
- EV濃度は、600 μL から20 mL の範囲の精製されたコレクションボリュームで達成できます。
- サンプルをダウンストリーム処理に最適な量に濃縮
- サンプルをペレットに変換し適切な量に濃縮できます。
- ウェスタンブロッティング、質量分析、またはqEVRNA抽出キットを使⽤したRNA抽出後の分析などに対応
- キットには5mLの濃縮⽤粒⼦が含まれています。濃縮するサンプル量によって必要な濃縮⽤粒⼦の量は異なります。
| 精製に使⽤する qEVカラム | サンプル量 (mL) | qEV濃縮キットの 必要量(μL) |
|---|---|---|
| qEV single | 0.60〜0.80 | 50.0 |
| qEV original | 1.5〜3.0 | 100.0 |
| qEV2 | 6.0〜8.0 | 150.0 |
| qEV10 | 10.0〜20.0 | 200.0 |
qEV 磁気濃縮キット

※ qEV磁気濃縮キットは基礎的研究目的で使用願います。
臨床、医療行為には使用できません。
qEV磁気濃縮キットは、qEVカラムで精製した細胞外小胞(EV)を濃縮する目的で開発されました。機能化磁性粒子を使用することで、遠心分離や時間のかかるプロトコルを必要とせず、従来よりも迅速かつクリーンにEVを濃縮することができます。
qEV磁気濃縮キットは、スケールアップEV精製システム(PurePath)の一部としてEV診断の基礎研究の利用を目的とした新製品群の一部として開発されました。
1時間未満で精製から解析までトータルにご提案
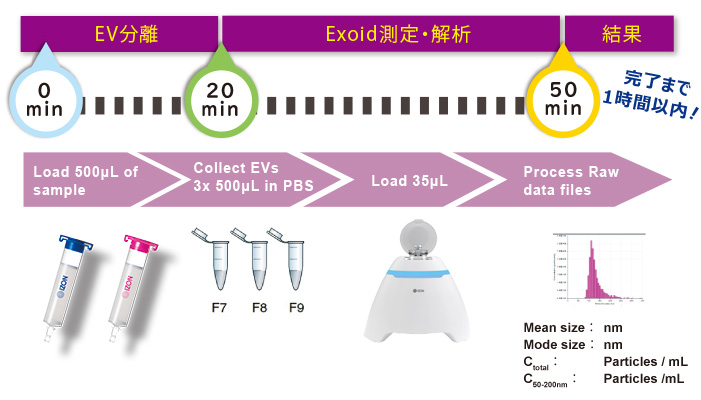
細胞外小胞は生物性の流体で、量的な分析を行う前に、複雑なバックグラウンドタンパク質を除外する必要があります。 qEVを使用することで、迅速に浄化することが可能です。 qEVはサイズ除外でクロマトグラフィーの手法を使用し、 凝集せずに、急速で、高く浄化することによって、容易に費用効果が高い作業が行えます。
通常EVの分離は数時間~1日以上かかりますが、qEVでは15分の短時間で抽出が完了します。 その後のExoidによる解析は、キャリブレーションも含め通常20分で終了し、迅速にデータ解析とPDFレポートの作成ができるため、全体の手順(精製+解析)は1時間未満で簡単に終わらせることができます。
qEVは高精度な解析を実現( qEV と他手法の比較)
| 手法 | 抽出方法 | デメリット |
|---|---|---|
| 超遠心法 | 超遠心装置を使用し、ペレットダウン法、 スクロール法、密度勾配法で抽出。 | 超遠心装置が高額で、1回の作業に数時間から十数時間かかる。 抽出結果の再現性が低い。 |
| PEG 沈殿法 | PEGで細胞外小胞を凝集させ 分離する方法。 | 細胞外小胞以外の物質も多く含む。 PEGが抽出物に入る。 |
| 磁気ビーズ法 | 細胞外小胞に磁気ビーズを反応させ、 磁気によりビズを分離。 | 磁気ビーズが細胞破砕物にも結合してしまう。 細胞破砕物も一緒に回収してしまう。 |
| 抗体法 | 抗体を細胞外小胞表面に結合させ、 抽出を行う。 | 細胞外小胞表面には様々なタンパク質が付着している。 抗体と反応する細胞外小胞しか回収できない。 |
| SEC 法 ( qEV ) | qEVの手法。サイズ排除により 狙ったサイズの粒子を抽出。 | ISO13845を取得しているのはqEVだけ。 短時間で誰でも再現性のあるピュアな細胞外小胞抽出が可能。 |
qEVの分離システムSEC (EVのサイズ排除クロマトグラフィー)はEVの構造の完全性を保ち、綺麗な分布を出すことで、EVを常に測定できます。 超遠心法とPEG 沈殿法はどちらも、不一致性・コンタミ・凝集の問題を含む様々な理由により、分離メソッドに不適です。
また、EVは物理的サイズが小さく不均質であるため、共焦点顕微鏡法/フローサイトメトリー/動的光散乱(DLS)/ナノ粒子トラッキング解析(NTA)/電子顕微鏡法(EM)を含む多くの解析技術において、制限を受けることにもなります。EMではEVの問題を解決できますが、定量的・ルーティンのスクリーニングに実用的でなく、真空により粒子を変えてしまいます。
qNanoでの測定メソッドと結果
サンプルの前準備
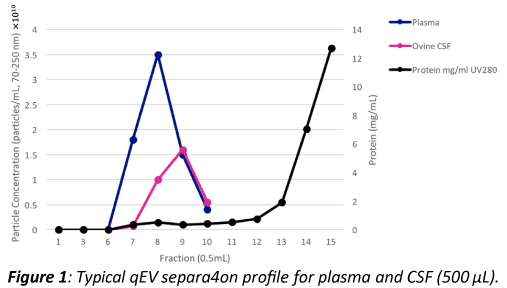
以下アプリケーションでは、細胞外小胞(EV)は羊の脳脊髄液と人間の血漿から得たものを利用しました。どのサンプルも、一連の10分間の遠心分離ステップを3回実施することで(脳脊髄液 1500g, 3000g, 10,000g; 血漿 1500g, 3000g, 3000g。どちらの場合も上澄みはとどめている)、残存細胞破片を取り除きました。事前に平衡を保った標準qEVカラムには50uLのサンプルを入れ、500uL分が集められました。EVは通常7-9の区分で溶出します( Figure 1参照)
qNanoのセットアップ
それぞれの測定は、qNanoとIzonソフトウェア バージョン3.1を用いて行われました。下部フルイドセルには電解液(75uL)が含まれ、上部フルイドセルには35uLのサンプルが含まれていました。qNano解析の前に、どのサンプルも先述のqEVカラムで精製しました。各サンプル測定毎にPBS(35uL)を上部フルイドセルに複数回入れてシステムを洗浄し、残存粒子が別のサンプル測定時に残らないようにしました。
このような電気抵抗ナノパルス法を用いた装置に関する詳細な記述は別の箇所に記載があります。ポアは濃度が分かっている200nm (平均210nm)のCPCポリスチレン粒子( 5.0 x 109/mL )を用いて3つの圧力を与えることによって(10, 8, 5 cmH2O)キャリブレーションしました。サンプルは同じ電圧と圧力において、一貫したベースライン電流を用いて解析し(例: 135 nA ± 2-5% max .)、各測定の間の比較データセットが有効なものとなるようにしました。
CSF及び血漿サンプルのTRPS解析
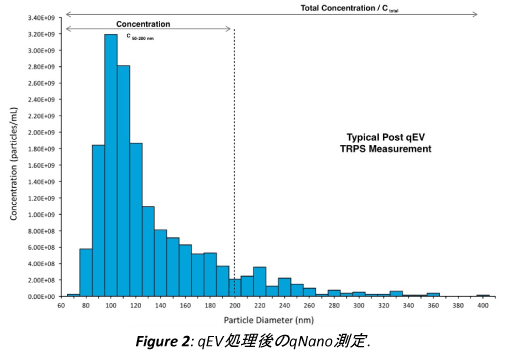
qEV分のCSFおよび血漿サンプルは電解液で希釈され、上述の通りqNanoで解析します。血漿及びCSFのEVはqEVの7-9の分量に溶出し、ピークの分量は血漿の場合F8に含まれており、CSFの場合はF9に含まれていました(Figure 1)。一部のEVはF10で溶出しましたが、この分量だと通常タンパク質にさらに汚染されますので、通常無視されます。典型的な粒子サイズのグラフと濃度データはFigure2の通りです。 生物学的サンプルが低レベルのEVを含んでいる場合は、スピンフィルターを用いた更なる濃度のステップがqEVによる精製前もしくは後に必要となります。これは尿サンプル/細胞培養の上澄み/凍ったヒトのCSFサンプルによくあることです。
EVの生物学/形態学の特長を保持したまま分離可能
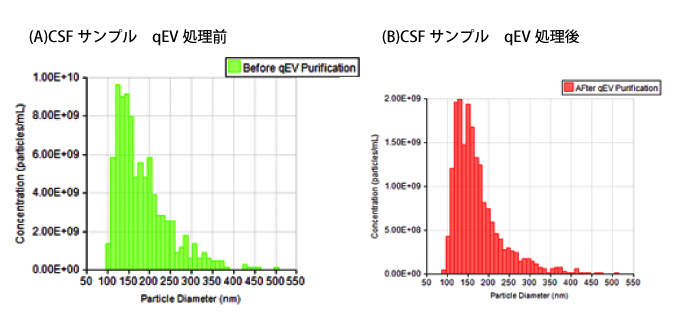
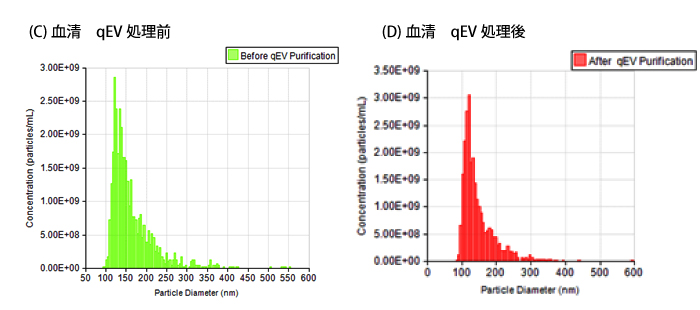
下図の2つのサイズ分布プロファイルの比較により、qEVによる精製ではEVのサイズ分布プロファイルに大きな影響を全く与えないことがわかります。 予想通り、細胞残屑などが処理された分、濃度の減少が一部見られます。
CSFサンプル qEV処理前後比較
血清 qEV処理前後比較
分析・測定の感度と精度の向上

qEVサイズ分離カラムにはポアサイズ約75nmの樹脂が含まれています。 EVより小さいタンパク質、及びコンタミとなる分子は、樹脂のポアに入りカラム内の通路で遅れ、 後のフラクションで溶離します。
qEVでの分離を行う時間は、2つの要素から成り立っています
1. カラムをつり合わせるための準備時間(通常10分)
2. サンプルの抽出時間(約5分)
タンパク質の除去
理想的な環境下においては、小胞の SEC 精製によってコンタミとなるタンパク質を99 % 除去できます。(※SEC = サイズ排除クロマトグラフィー)
脂質の除去
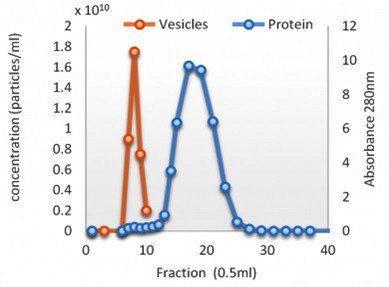
超遠心分離法の重大な問題は、HDL / LDL粒子の密度がEVの密度と類似していることにより、 粒子がEVと共に分離してしまうことがよくあることです。 EVから適切なフラクションを収集すると、EVサンプルからコンタミとなるHDLを95%まで除去することができます。
左のグラフはqEVカラムによる溶出結果を280nmのUV吸収で測定されたバックグラウンドにあるタンパク質及び成分です。 EVはフラクション7-9ににかけて溶離しており、タンパク質はフラクション10-30で検出されています。
EV抽出は15分以内に
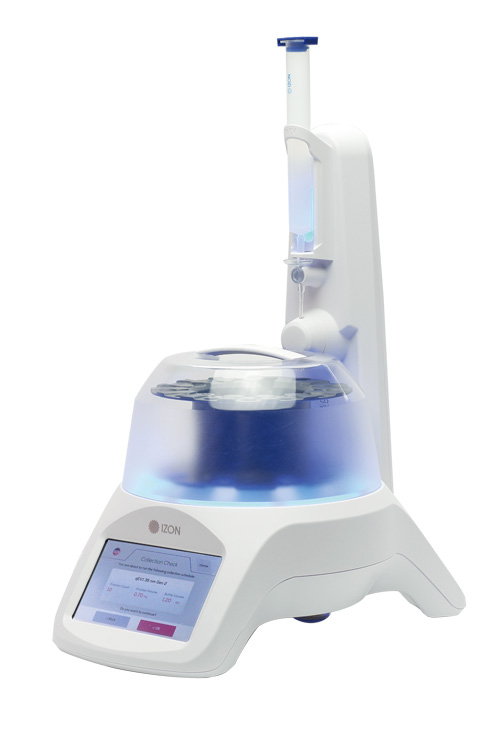
qEVカラムの簡便で迅速な性質により、qEV分離は最も⼀般的なEV分離⽅法の1つです。qEVカラムをAFC(オートフラクションコレクター)と⼀緒に使⽤すると、効率、再現性がさらに向上します。
AFC(qEV オートフラクションコレクター)は、分離プロセスをガイドし、⾃動容量測定と収集の貴重な要素を導⼊します。AFCを使⽤すると分離が発⽣している間も他の作業を進めることができるため、1⽇の貴重な時間を節約できます。


