NanoFCM によるLNPの解析事例
ナノスケールフェノタイピングが実現するLNP解析


NanoFCM フローナノアナライザー
核酸医薬の挙動は、その組成や特性、粒度分布、形状、表面特性、粒子濃度、薬物負荷効率、標的リガンドの種類と密度など、さまざまな物理化学的特性によって決定されています。これらの特性を包括的に評価することは、核酸医薬の設計、開発、品質管理を向上させることにつながります。
NanoFCMは 7-1000nmの粒子測定に特化した包括的なナノ粒子特性評価プラットフォームであり、単一粒子レベルでの高分解能なサイズ分布と粒子濃度、フェノタイピング解析により、薬剤カプセル化効率や核酸局在アッセイ等の定量分析が可能です。(表1.)これらのマルチパラメーター解析を行うことで、核酸医薬の研究開発や製造領域、品質管理などの各種ワークフローにおけるデータ取得を行うことが可能です。
ここではNanoFCMを用いた核酸医薬解析におけるさまざまな測定事例をご紹介します。
アプリケーション事例
サイズ&濃度のラベルフリー解析
LNPが核酸医薬やmRNAワクチンのナノキャリアとして使用される場合、その粒子サイズは自然免疫刺激およびナノ粒子の組織および細胞分布に影響を与え、粒子濃度はナノメディシンの最終的な治療効果に直接影響する重要なパラメータです。
NanoFCMはこれらのナノメディシンのサイズ分布と濃度をラベルフリーで分析することができます。本測定でサンプルとして使用したmRNA-LNPは(図1.)に示すように40-200nmの粒度分布を持ち、サイズの中央値は97 nmでした。また、このサンプルの粒子濃度は単粒子測定法では 3.11E+11 particles/mL であり、この結果を検証するために同一サンプルに対して複数の希釈系を測定することで結果の検証を行っています。(図2.)
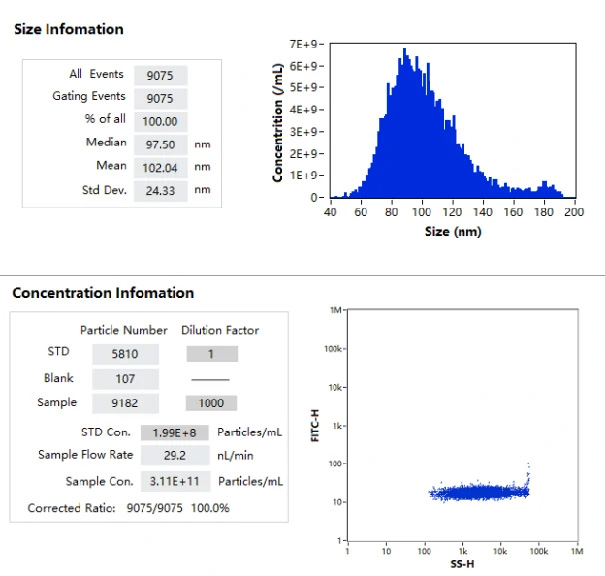
図1.mRNA-LNPのサイズ分布および濃度測定
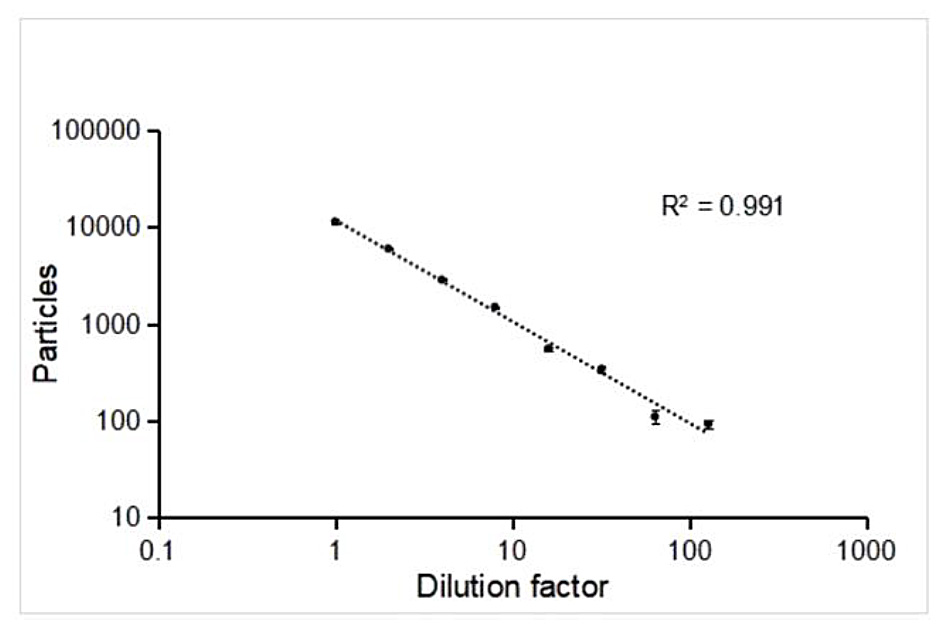
図2. 段階的希釈によるmRNA-LNPの濃度解析
サンプルを1~100倍まで段階的に希釈し、NanoFCMによって検出された粒子個数をプロットしています。
LNP負荷粒子比率
カチオン性脂質は核酸をカプセル化しエンドソーム脱出を促進するため、核酸医薬の合成工程において広く用いられていますが、カチオン性脂質上の電荷の存在が毒性につながるため、すべての粒子に対してより効果的にmRNAを搭載し、その評価を行うことが重要となります。
また、RNA干渉(RNAi)の手段としてsiRNAを内包したLNPが検証されていますが、その利用においては正確な粒子数および担持粒子の割合や比率を求める必要があります。
NanoFCMはSPCMモジュールによる優れた光散乱感度により、サンプル中に存在するほとんどすべてのLNPを検出し、核酸染色を使用して蛍光検出を行うことにより、粒子の負荷割合と治療薬のカプセル化効率を評価することができます。
ここでは、NanoFCMを使用して、Alnylam Pharmaceuticals (米国マサチューセッツ州ケンブリッジ) が調製したsiRNA LNPおよびコントロールとなるEmpty LNPについて特性評価を行いました。
サンプルは細胞透過性核酸染色色素のSYTO82とインキュベートし、LNP内部の核酸を標識しています。 測定の結果、(図3.)に示すように、Empty LNPとsiRNA LNP は蛍光シグナルに基づいて容易に識別でき、この結果を用いてそれぞれの集団定量評価することができます。
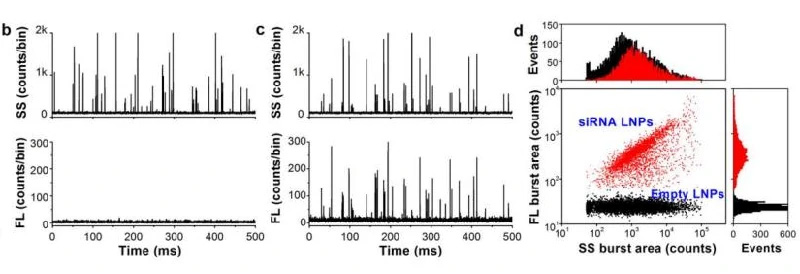
図3. siRNAの有無によるLNPの定量評価
(b,c) LNPサンプルの側方散乱光(SS)および蛍光(FL)シグナル。
それぞれ (b)siRNAがロードされていないLNP(c)siRNAがロードされたLNPを示しています。
(d)LNPサンプル(b,c)の混合物におけるSS-FLの2変量解析ドットプロットを示しています。
また別の研究では、異なるLNP合成試薬を用いて製造した2種類のmRNA-LNPにおけるmRNA担持率を評価しました。
各サンプルには同一の蛍光標識を行いNanoFCMで解析を行った結果、それぞれ97.7%と90.3%の割合でmRNAがLNPにロードされていることが確認されました(図4.)。また、これら2つのサンプルにおいて、Y軸に示した担持画分の定量結果と蛍光の相対強度から、各サンプルの違いを評価することも可能です。
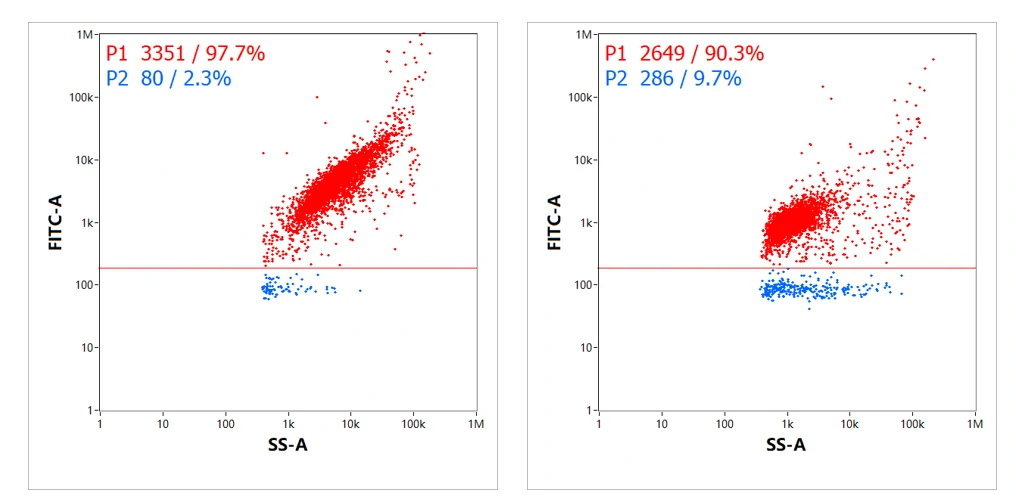
図4. 製造方法が異なる2種類のmRNA-LNP測定
蛍光強度(FITC-A)はドットプロットのY軸に沿って示されており蛍光染色されたRNAの量を示しています。
ドットプロットの分散状態からもそれぞれのサンプル特性を評価することができます。
LNP内在のmRNAコピー数の解析とカプセル化効率
NanoFCMの測定においてmRNA-LNPを細胞透過性核酸染色試薬で標識すると、mRNAを担持しているLNPと遊離mRNA由来のシグナルが蛍光チャンネルにおいて識別されます。このとき得られた微小な蛍光シグナル(図5. 矢印)に対して、蛍光標識された純粋mRNA分子(図6.)を対照とする解析を行った結果、ここで得られた微小な蛍光シグナルは単一の遊離mRNA由来のものであることが確認されました。
また、NanoFCMの解析プラットフォームにおいてFITCシグナルとSSシグナルの2変量解析プロットに対してFLトリガーを適用することより、遊離mRNAとmRNA-LNPのクラスタを表示することができます(図5.右)。この測定結果より、mRNAは溶液中で遊離した状態と、LNP内に内包された状態の2つの状態で存在することがわかります。また、カプセル化効率= LNPに内包されたmRNAの量 /カプセル化された mRNAと遊離mRNAの総量、とすると、(図5.)と(図6.)に記載されたサンプルにおけるmRNAのカプセル化効率は80.5%と決定されました。
さらにヌクレオチド数と蛍光強度の線形相関を取り、各LNPの蛍光強度を単一遊離RNA分子の蛍光強度で割ることで、LNPあたりの内包RNAコピー数を定量化することができます(図7.)。
この例において、LNP 1粒子あたりに内包されているmRNAのコピー数の中央値は約12 mRNAと解析されました。 カプセル化されていないmRNAは不安定な状態であり体内で分解されるため、WHO(世界保健機関)においてmRNAのカプセル化の程度は重要な品質属性とみなされるべきであると強調されています
このようにNanoFCMの解析プラットフォームにおいてmRNA-LNPのデータを解析すると、mRNAを担持しているLNPの存在割合を算出すると共にサンプルのカプセル化効率を決定することができます。
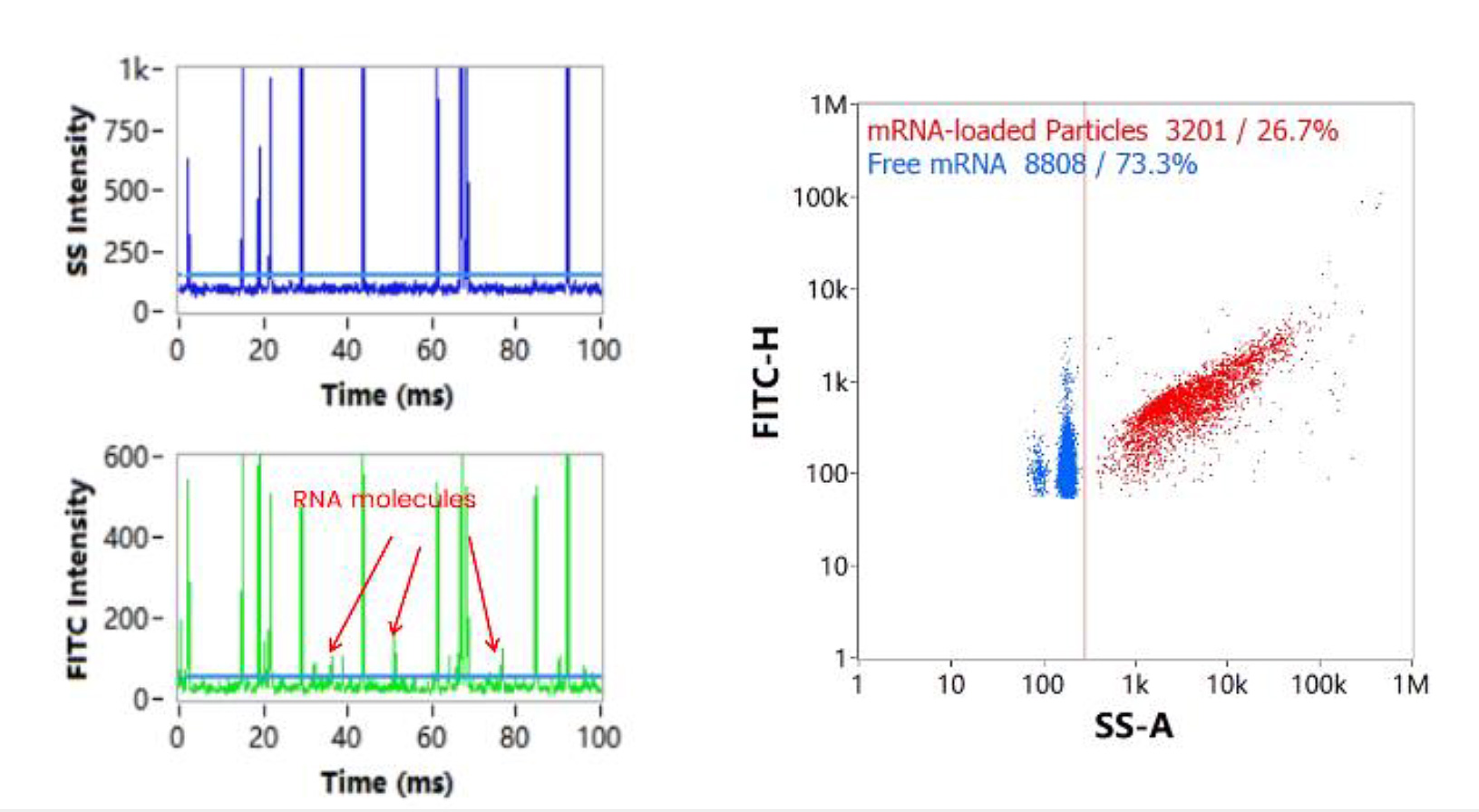
図5. mRNA-LNPの解析と遊離mRNA検出
FITCチャンネルにおいて側面散乱が検出できない小さな粒子(遊離mRNA)由来の蛍光シグナルが検出されています。
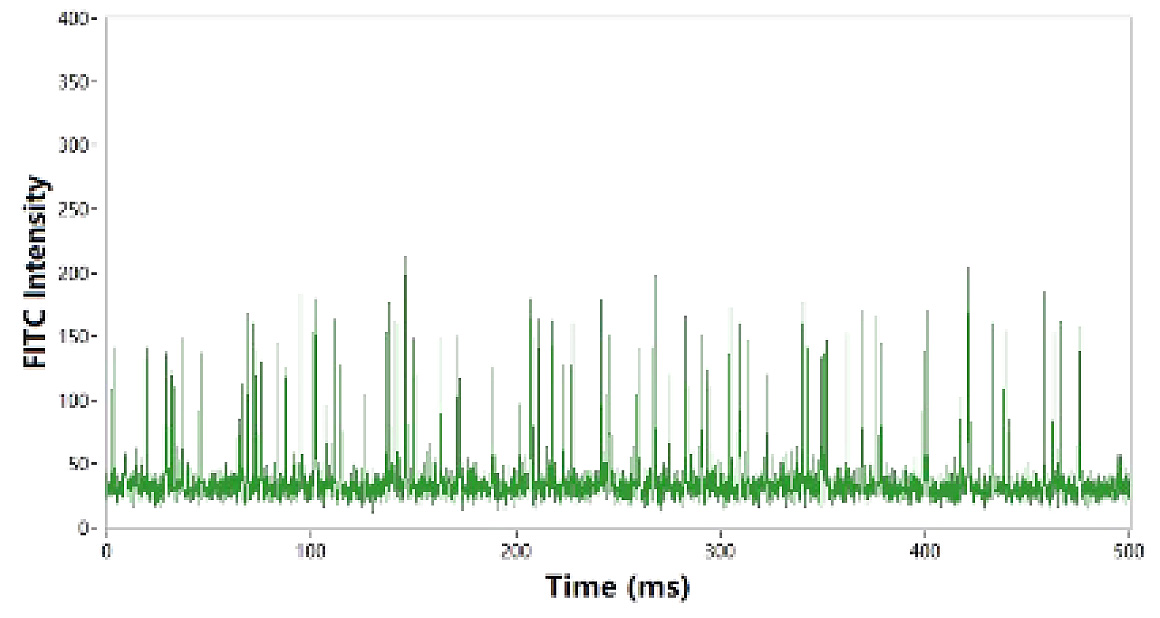
図6. 遊離mRNAの蛍光測定
蛍光標識された純粋mRNA分子の蛍光強度は約100程度であり、図5.の矢印で示す蛍光シグナル強度と近しい値が得られています。
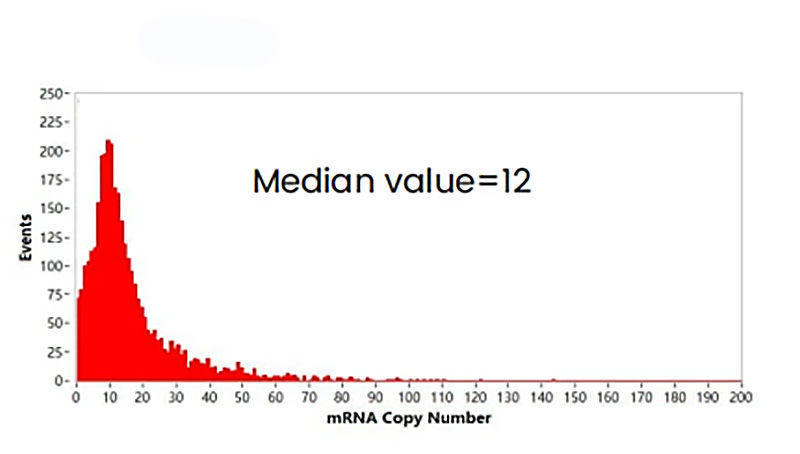
図7. mRNAコピー数の分布
検出されたmRNA-LNPの蛍光強度を単一遊離mRNA分子の蛍光強度で割ることで、LNPあたりの内包RNAコピー数を定量化することができます。このデータではLNPあたりのコピー数の中央値は12 mRNAです。
核酸の局在アッセイ
mRNAワクチンのサブポピュレーション解析
mRNA-LNP製剤には3つの主要なサブポピュレーションが存在し、それぞれ(図8.)に示されるVaccine(P1、赤)、Non-loaded Vaccine(P2、青)、Free RNA(P3、黄)とに区別することができます。実際にmRNAワクチンを模式したmRNA-LNPサンプルを細胞透過性の核酸染色色素で標識したものを測定し、SS-FLデュアルトリガーを使用して、3つの集団を1つの図に示すと各サブポピュレーションにおける濃度割合は44.0%,1.7%,52.7%となります。
このサンプルに対してRNase処理をすると、Free RNAであるP3の集団が消失しました(図9.)。一方でP2の濃度割合が増加していることから、P1の粒子の中にはLNP表面にmRNAが付着していた粒子が存在し、RNase処理によってこの粒子が失われたことが示唆されます(図9.右図)。
また、細胞不透過性の核酸色素で標識した後に検出される蛍光シグナルは、LNP表面に結合したmRNAとFree mRNAに由来します。そこで、SS-FLデュアルトリガーを使用し各集団の解析を行うと、(図10.)におけるP3はFree mRNA、P2はEmpty LNPであり、P1はmRNAがLNPの表面に吸着した粒子であると考えることができます(図10.左)。また、このサンプルに対してRNase処理を行うと、P1とP3の個体数は激減しています(図10.右)。
表2. はこれらの標識戦略によるmRNA局在アッセイの結果をまとめたものであり、より高品質なmRNA-LNPの製造のための分析に活用いただくことができます。
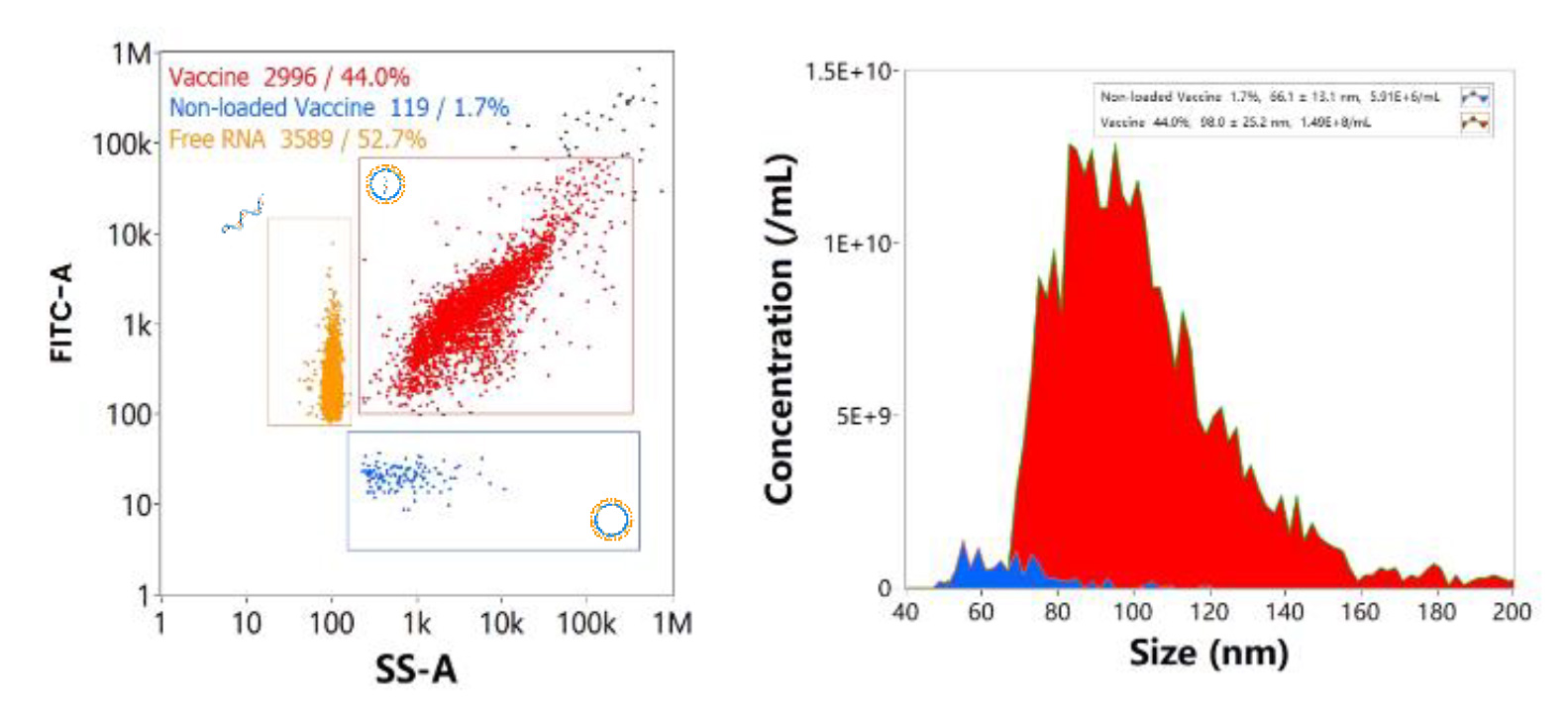
図8. mRNAワクチンにおける代表的な集団分布
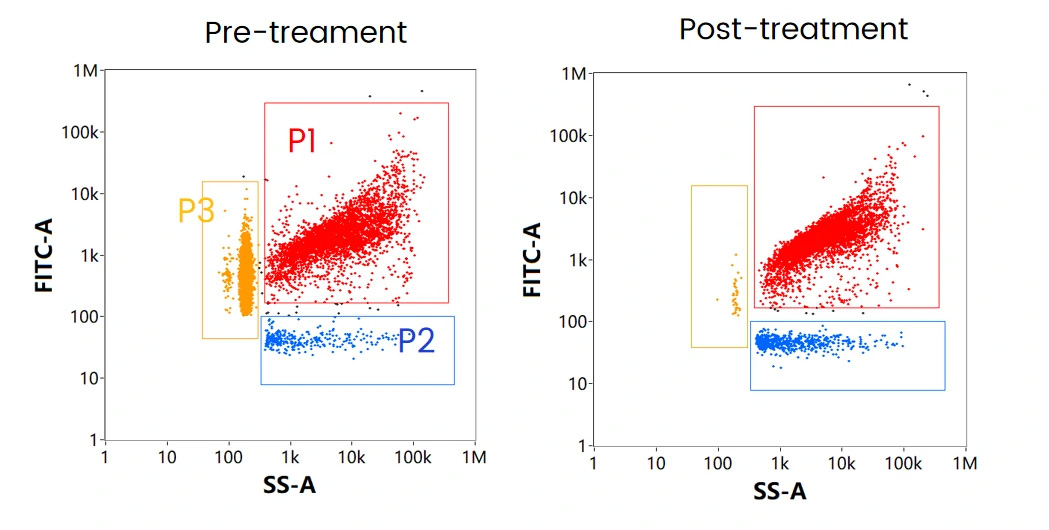

図9. 細胞透過性核酸染色によるmRNA-LNP解析
(左:未処理、右:RNase処理後)
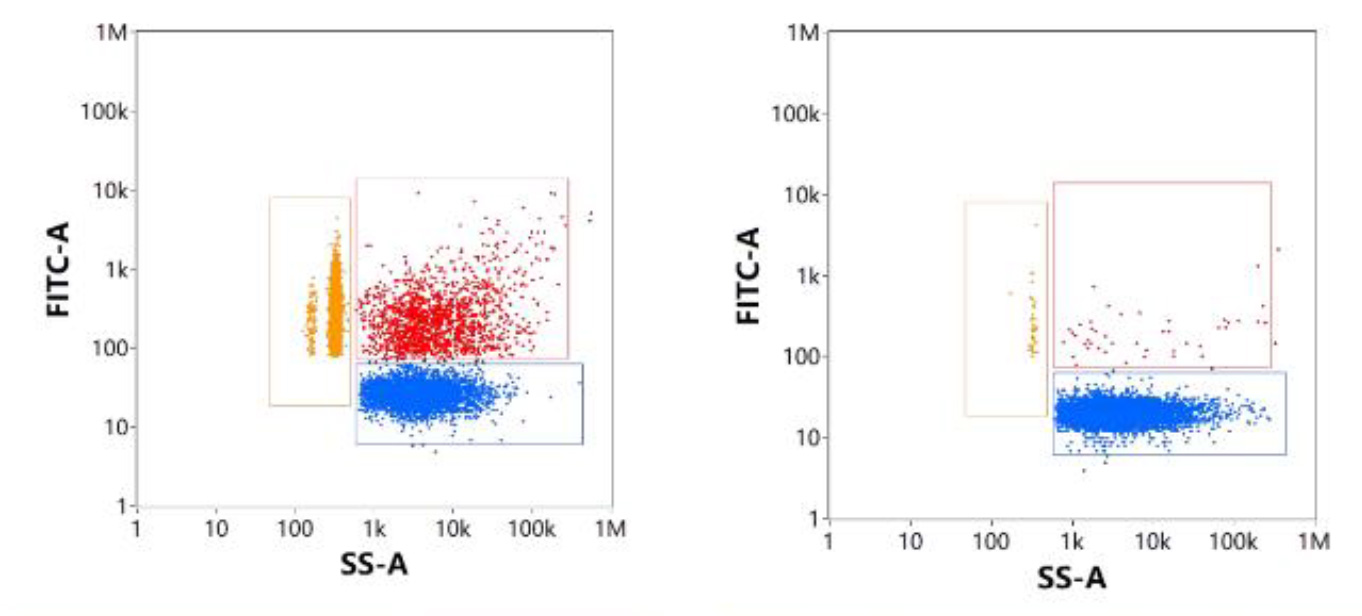

図10.細胞非透過性核酸染色によるmRNA-LNP解析
(左:未処理、右:RNase処理後)
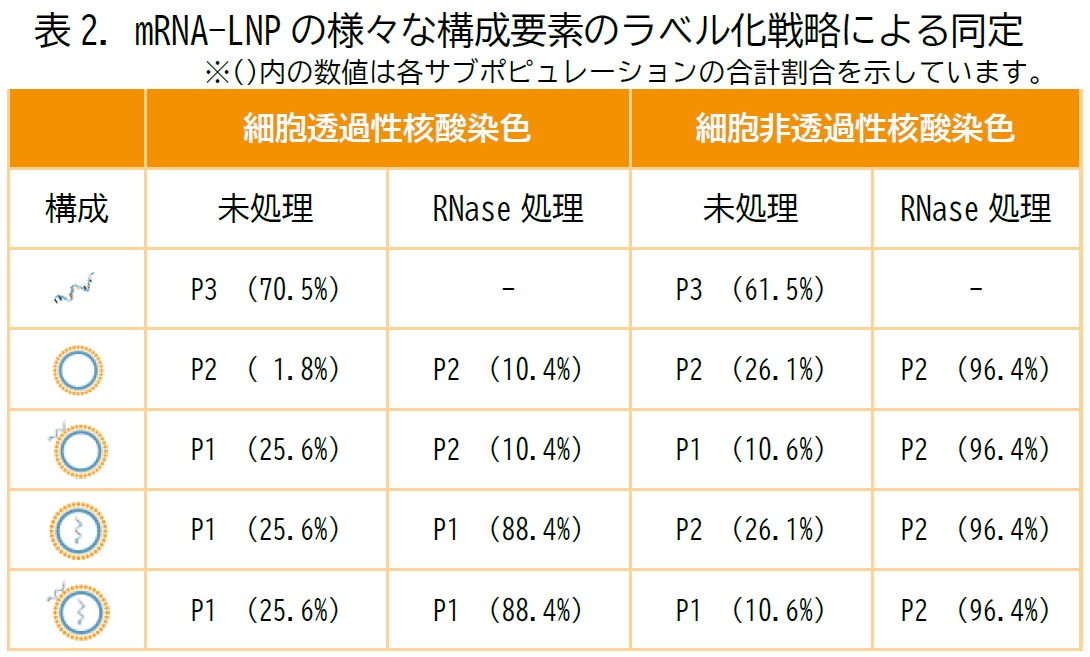
表面リガンドの定量解析によるナノメディシンの高機能化
核酸医薬の治療効果をさらに高めるための戦略として、薬物送達を選択的に行うためのアクティブターゲティングが注目されています。表面リガンドには、タンパク質、ペプチド、アプタマー、低分子など様々な種類があります。標的ナノ粒子上のリガンドのキャラクタリゼーションは通常アンサンブル平均法で行われていますが、従来の方法では粒子間のばらつきに関する情報を得ることはできません。また、表面リガンドの密度は細胞内へのリポソームの取り込みに重要な役割を果たすため、1粒子単位で正確に定量化することは重要です。
そこで、葉酸修飾リポソームをモデル系として、NanoFCMを用いた表面リガンドの定量実証試験を行いました。リポソーム表面の修飾葉酸リガンドを認識するために、蛍光標識された組み換え葉酸レセプターを利用しました。NanoFCMの解析では、各リポソームについて側方散乱(SSC)と蛍光シグナルを同時に取得しました。SSC強度の校正には単分散SiNPを、FL強度の校正には等価可溶性蛍光色素(MESF)の単位で明るさが既知の蛍光SiNPを使用することで、サンプルの粒子径とリガンドの数を定量化しました(図11)。
解析の結果、葉酸のリガンド密度はリガンドを投入すると増加し続けることがわかり、リポソーム設計における柔軟性が浮き彫りになりました。しかし、細胞への取り込みに最適な密度は、100nm2 あたり0.5から2.0リガンドの間に収まりました。また、この数値はほとんどのウイルスのスパイク密度とよく一致しています。 この手法はトランスフェリンやHER2抗体など、他のターゲティングモチーフのリガンド密度測定にも用いることができ、薬物送達システムにおける調製プロトコルの最適化やバッチ間の品質管理などの前臨床開発に活用可能です。
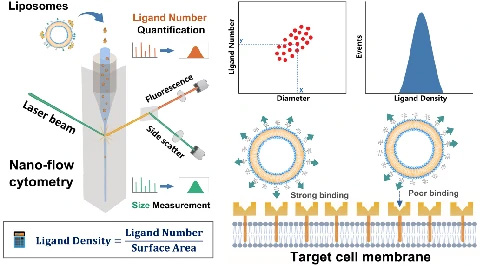
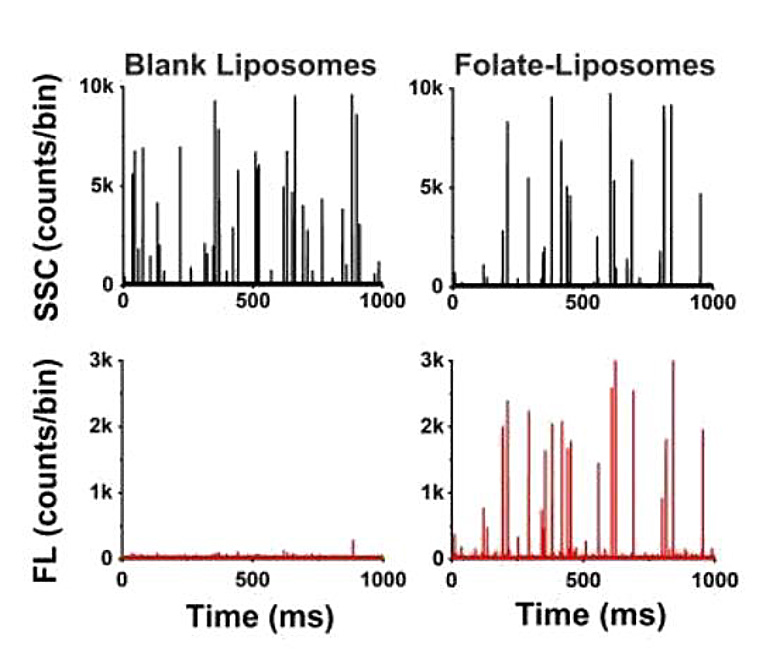
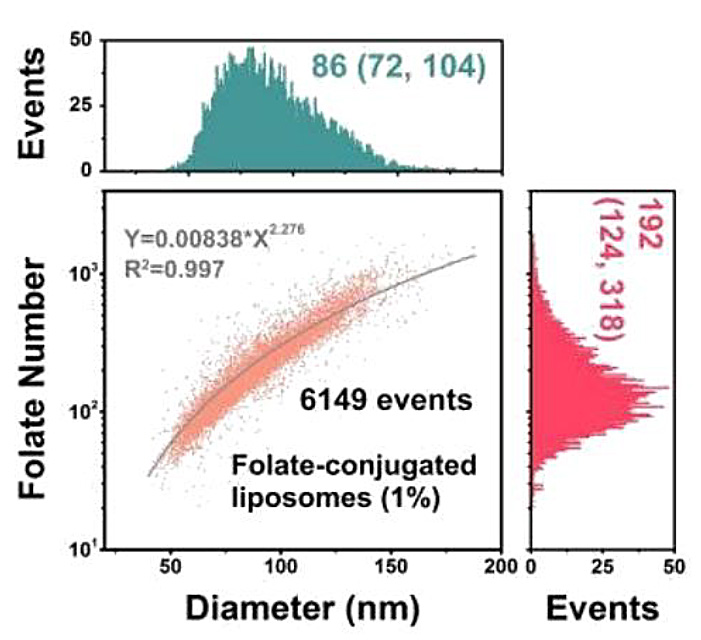
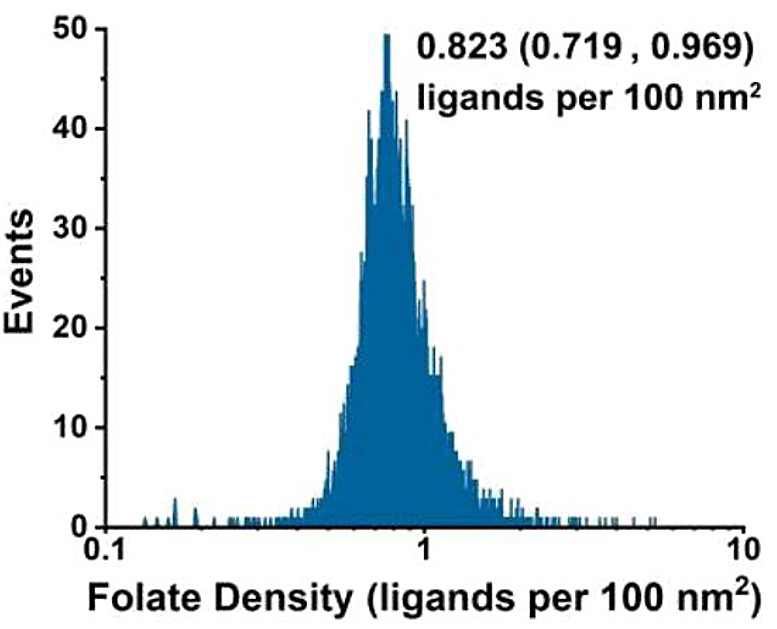
図11.リガンド結合リポソームの測定
(a)NanoFCMにおける測定イメージ (b)リガンド定量工程の模式図 (c)空のリポソームとリガンド結合リポソームのSSC,FLシグナル (d)リポソームにおけるFolate-Diameterドットプロット (e)リガンド密度の定量化
ナノメディシン産業におけるNanoFCMの応用例
核酸治療薬は疾患の遺伝子基盤を標的とすることができるため、多くの難治性疾患に対して治癒の可能性を提供し医薬界に革命をもたらしています。またmRNAワクチンは迅速に多様なワクチンを開発することができるため、未知のパンデミックに対する強力な武器となります。
しかしながら、治療目的のための効果的な遺伝子デリバリーや効果的なワクチンの開発には依然として様々な課題があるため、より優れた核酸送達システムや核酸担持方法を開発し、ナノ粒子の物理化学的特性とその挙動との関係をより深く理解することで、特定の組織/細胞への革新的かつ選択的なターゲティングを促進することが可能となります。NanoFCMは包括的なLNP特性評価のためのプラットフォームを提供し、研究開発、生産/製造、精製、品質管理プロセスなど、核酸医薬のワークフローに広く応用することが可能です(図12.)。
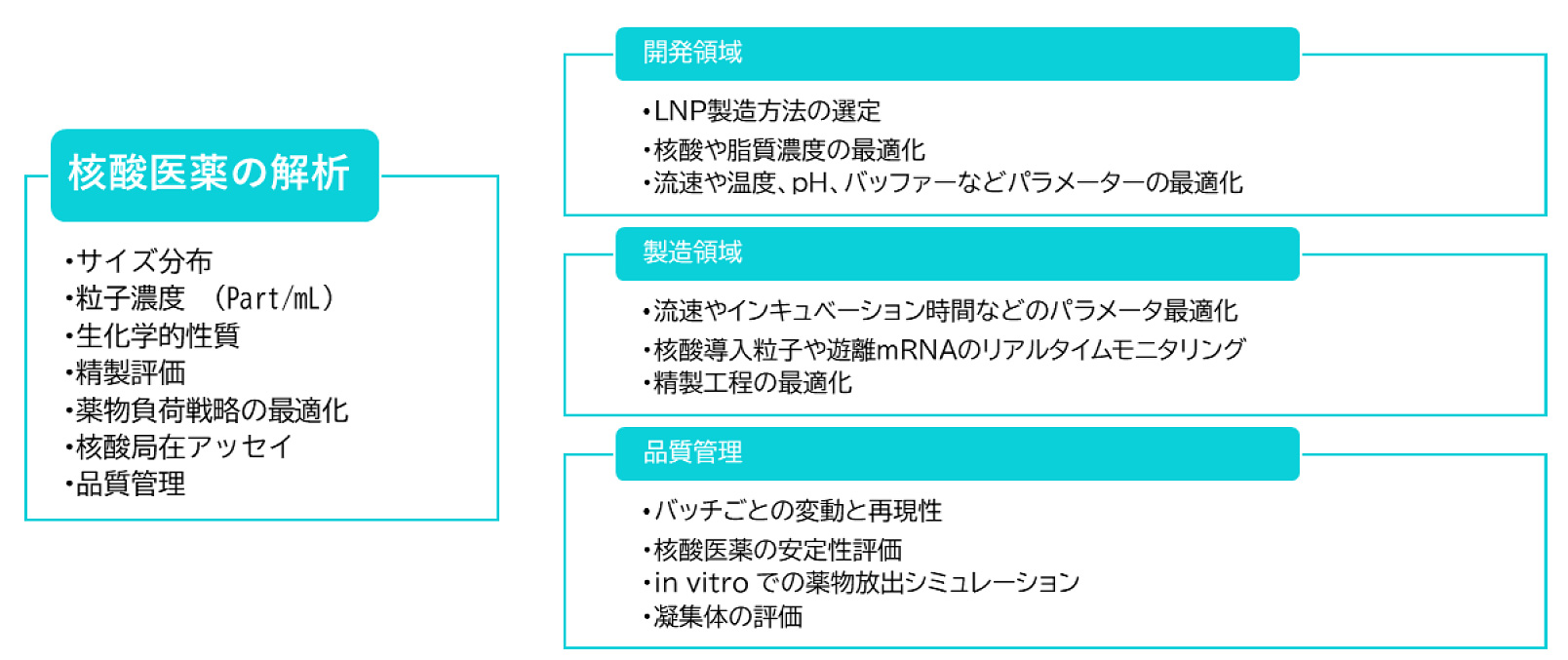
図12.核酸医薬におけるNanoFCMの解析項目と各領域におけるワークフロー
出典
- Liu M, Zhou T, Sheets R, et al. WHO informal consultation on regulatory considerations for evaluation of the quality, safety and efficacy of RNA-based prophylactic vaccines for infectious diseases, 20–22 April 2021[J]. Emerging microbes & infections, 2022 (just-accepted): 1-16.
- Hassett KJ, Higgins J, Woods A, et al. Impact of lipid nanoparticle size on mRNA vaccine immunogenicity[J]. Journal of Controlled Release, 2021, 335, 237-246.
- Zhu S, Ma L, Wang S, et al. Light-Scattering Detection below the Level of Single Fluorescent Molecules for High-Resolution Characterization of Functional Nanoparticles[J]. ACS Nano, 2014, 8(10):10998-11006.
- Chen C, Zhou Y, Chen C, et al. Quantification of Available Ligand Density on the Surface of Targeted Liposomal Nanomedicines at the Single-Particle Level[J]. ACS nano, 2022, 16(4):6886-6897.
- https://www.modernatx.com
- Evaluation of the quality, safety and efficacy of messanger RNA vaccines for the prevention of infectious diseases: regulatory considerations (POST-ECBS version). World Health Organization, October 2021.

