組織工学の三要素 ~バイオ3Dプリンティングの基礎知識~
組織工学 ドナー不足の緩和を目指すバイオテクノロジー
![]() ーもくじー
ーもくじー
組織工学(Tissue Engineering)は損傷した組織や臓器を置換・修復し、その機能を回復させるために人工的に生体組織構築を行うことに焦点を当てた研究分野であり、生体材料と細胞を用いた治療法の相乗的な進歩により人工組織の製造が大きな関心を寄せられています。この組織工学の究極の目標は、機能的な生物学的構造をin vitroで製造することによってドナー不足を緩和することにあります。
組織工学技術は「細胞」、「シグナル伝達機構」、「バイオマテリアル」の3つを基本としています。機能的な組織を作るために、バイオマテリアルの足場上で細胞培養が行われ、その後、細胞接着、増殖、分化、細胞外マトリックスの沈着を指示する適切な生物物理学的および化学的シグナルが与えられます。ここではこれらの組織工学における3要素の概要とそれぞれの役割について解説します。
組織工学の三要素とは? ~バイオ3Dプリンティングの基礎知識~
組織工学は以下の3つの主要な構成要素の相互作用によって成り立っています。
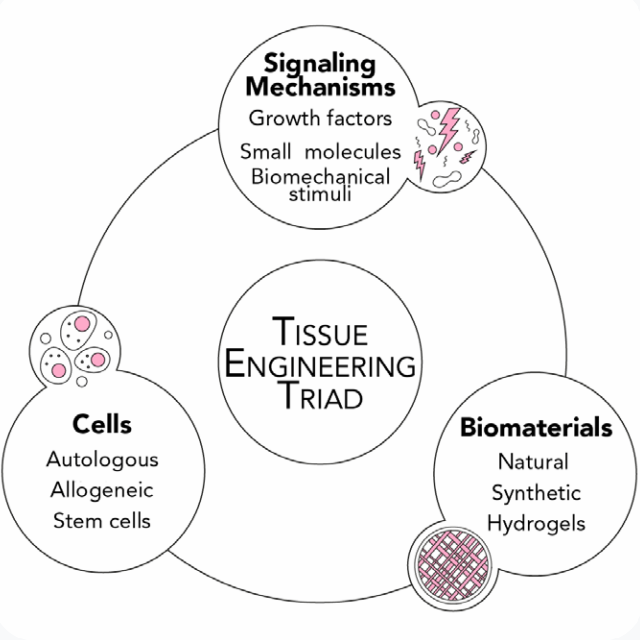
- 新しい生存組織を形成する細胞
:幹細胞、オートロガウス、アロジェニック - 細胞を標的として刺激するシグナル伝達機構
:任意の組織表現型発現の誘導 - バイオマテリアル
:組織形成のためのスキャフォールド
これらの三要素は様々な組織において、特定の用途に合わせて最適に調整する必要があります。したがって、これらの相互作用を理解することは組織工学において適切な構造物を製造する上で極めて重要となります。
人工組織を形成する細胞
生物の再生プロセスは、外来性または内因性の細胞を欠損部位に送達する様々な戦略に依存しています。単離された細胞がバイオマテリアルと組み合わせられて移植されることもあれば、さまざまな種類の細胞を生体外で増殖させて標的部位に直接移植することも可能です。このような組織工学に使用される細胞は用途によって使い分けられます。 供給源による分類では、患者自身から得たという意味のAUTOLOGOUS(オートロガウス:自家由来)と、適合する他のドナーから得たという意味のALLOGENEIC(アロジェニック:同種由来)の2種類に区別することができます。 その他にも細胞分化の度合いの観点から、分化した体細胞と未分化の幹細胞にも分類することができます。一般に体細胞は患者の特定の組織から得ることができますが、体外での増殖能力が低いため治療応用に必要な十分な数の細胞を得ることは困難であり、体細胞は再培養するとその特徴的な表現型が失われることがあります。
オートロガウスとアロジェニック
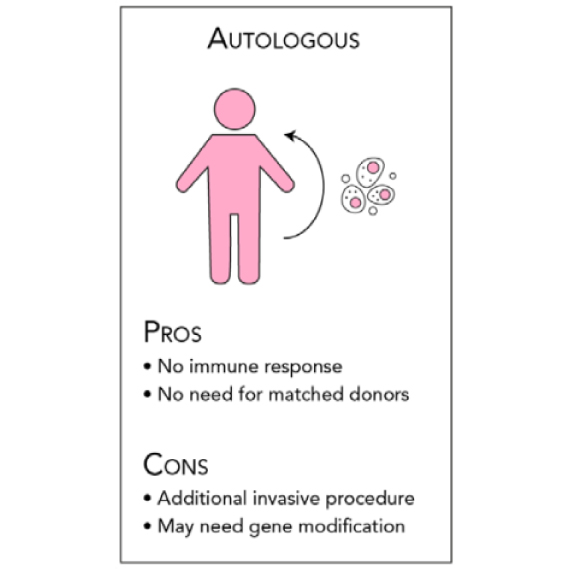
AUTOLOGOUS(オートロガウス)
患者自身の細胞であり、培養された自己細胞が再度患者の体内に導入されて損傷した組織を修復することができます。この種の治療は細胞が同じ個人に属するため免疫学的に理想的であり、免疫拒絶の問題を大幅に軽減することができます。特に自己細胞の供給源として骨髄が最も多く利用されています。
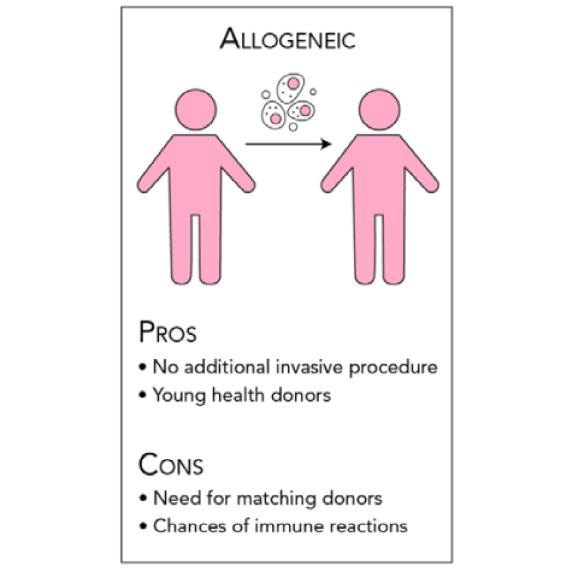
ALLOGENEIC(アロジェニック)
細胞移植を受ける患者と異なる別の個人から提供される細胞です。この治療ではドナーの細胞が患者の細胞と適合するヒト白血球抗原(HLA)を持っている必要があります。通常、免疫反応は最小限に抑えられますが、免疫学的拒絶反応によって移植されたドナーの細胞が死亡する可能性があります。
アロジェニックに関連する細胞の供給源として異種移植(Xenotransplantation)が挙げられます。この手法ではドナーとレシピエントは異なる生物種であり、細胞や組織の入手性において他の手法よりも有利な場合があります。しかしドナーにゲノム編集を行った場合においても免疫学的非互換性が高いため拒絶反応を起こす確率が高いことが課題とされています。
幹細胞
幹細胞は複製や自己再生、特殊な細胞への分化を行うことができ、体内の臓器や組織機能おいて発生、成長、維持、修復に不可欠な役割を果たしています。これらの細胞は未分化であり、生体の修復システムとして機能し他の細胞を補充することができるため、幹細胞培養を用いた組織工学的アプローチは再生医療の分野において大きな注目を集めています。
幹細胞はその分化能力や「可塑性」を反映する「効力」、あるいは発生段階を意味する「由来」によって識別され命名されます。由来が異なると細胞の力や自己再生能力、作用機序が異なる場合があります。したがって、由来に基づき、胚性幹細胞(ESC)、成体幹細胞、人工多能性幹細胞(iPSC)の3つのカテゴリーに大別されます。さらに、分化能の違いから、「全能性幹細胞」「多能性幹細胞」「単能性幹細胞」などのグループに分類することができます。
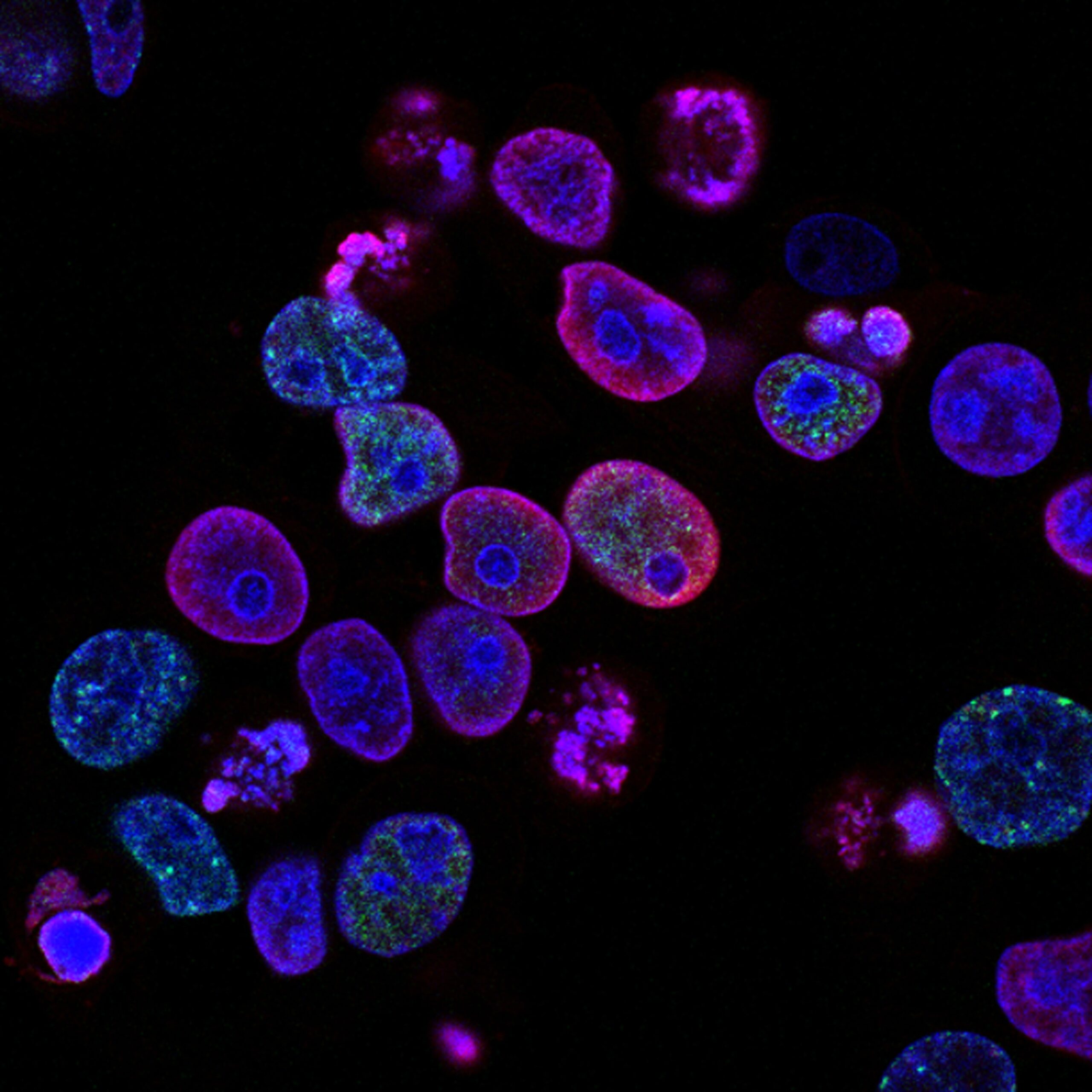
シグナル情報伝達
細胞の挙動は細胞外マトリックス(ECM)からの生化学的および生物物理学的なシグナルに強く影響されます。これらの制御シグナルは in vitro および in vivo における組織形成の制御と誘導に関連します。
- 成長因子
細胞外マトリックスに付着したタンパク質や、細胞から分泌される可溶性分子などのポリペプチドです。成長因子は標的細胞の表面にある特定の受容体に結合することにより、細胞とその微小環境との間で情報を伝達することができ、細胞の増殖、分化、移動、接着、および遺伝子発現を刺激または阻害することができます。また、同じ成長因子が異なる種類の細胞に作用して同じ効果や他の効果をもたらすと同時に、異なる細胞が同じ成長因子を産生することがありこれは多方向性と呼ばれています。 - 低分子化合物
低分子量(1kDa以下)の有機化合物であり、拡散性が高く成長因子よりも組織への浸透性が高いため、成長因子と同じ細胞内シグナル伝達カスケードをより効率的に活性化するように設計することができ、保存安定性が高く製造コストが低いため、経済的にも大きなメリットがります。しかし低分子を介した生体内組織再生は内因性恒常性や組織再生を制御するメカニズムの理解が限られているためまだ研究途上の段階です。 - バイオマテリアルと細胞への機械的刺激
細胞の挙動は生体力学的な刺激に強く影響されるため、生体力学的刺激を適切に与えることで細胞の分化にプラスの影響を与えることができます。機械的刺激における一般的な指標は、その大きさと時間および適用の頻度、形態、タイミングです。特に組織培養中の機械的刺激は、生来の人体組織を模倣したバイオプリント構造物の機械的および細胞的特性を改善するための効果的な戦略となります。
バイオマテリアル
バイオマテリアルの開発は組織工学において細胞集団や治療薬の効率的な送達、再生プロセスの加速と最適化などの重要な進歩をもたらしました。これらのバイオマテリアルは移植部位において組織に構造的支持と良好な機械的特性を与える必要があり、長年にわたって様々な加工技術や足場設計が行われ、組織工学的な構築物の品質を向上させるために研究が行われてきました。
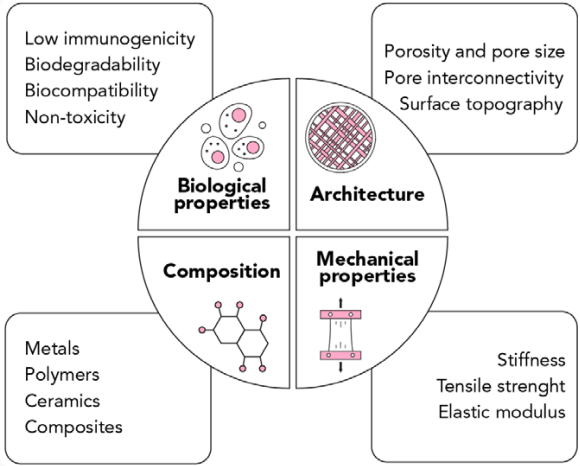
組織工学に適した足場を得るためには、いくつかの設計基準を満たす必要があります。
- 生体適合性:
あらゆる足場にとって不可欠な要素であり、細胞が表面に付着し、移動・増殖し、ECMを堆積させて新しい組織を形成できることが求められます。 - 低免疫原性:
移植後のバイオマテリアルによって引き起こされる炎症反応が最小限であることは、機能低下や生体による拒絶反応を避けるために極めて重要です。 - 生分解性:
足場が体内で分解される際に細胞が足場を置き換えることができるように、材料は高い生分解性を持っていなければなりません。
- 無毒性:
足場は永久的なインプラントとして設計されているわけではないので、分解の際に生じる副産物は無毒でなければなりません。 - 機械的特性:
理想的な足場は移植される解剖学的部位に適合する機械的特性を有していなければなりません。生体材料の機械的特性は生理的条件下での細胞の生存に必要な生体力学的シグナルを阻害することなく、一方で圧縮力や牽引力による損傷から細胞を保護するのに十分でなければなりません。 - スキャフォールドの構造:
細胞の浸透と細胞への栄養分の十分な拡散のために相互接続された孔構造と高い多孔性によってが必要となります。またこの多孔質構造は周囲の他の臓器や組織と干渉することなく、老廃物を足場から拡散させるためにも重要となります。
このような特性を満たすバイオマテリアルとして一般的に以下の材料が用いられています。
- 金属材料:金属材料はその優れた機械的性能や疲労や破壊に対する高い耐性から、整形外科用インプラントの製造の代替材料としてしばしば挙げられています。この種の材料は組織工学においても常に高い引張・圧縮荷重を受ける硬い組織の代替、強化、安定化を目的とした構造部材として使用されています。
- セラミックス:生体活性セラミックスや生体吸収性セラミックスには、リン酸カルシウムやバイオガラスなどの化合物が含まれます。これらの材料は生理的環境や歯や骨などの硬い組織と高い化学的適合性を持ちます。その用途は、人工気管、整形外科用補綴物、歯科再建、骨充填など、さまざまな分野に及んでいます。また一般にセラミックスは金属よりも密度が低く、電気や熱の伝導率が低い材料として扱われる傾向があります。
- 合成高分子材料:合成高分子材料はポリ乳酸(PLA)、ポリグリコール酸(PGA)、ポリ乳酸-コ-グリコール酸(PGLA)コポリマー、ポリ(ε-カプロラクトン)(PCL)など工業的な手順で製造された生体材料を指します。このような合成バイオマテリアルは機械的特性、分解速度、微細構造などを高度に制御できるため、様々な用途に合わせて調整することが可能です。
- 天然材料:天然材料は生体適合性や生分解性、毒性の低さ、固有の生物学的機能により、組織工学における様々な用途に適しています。さらに、再生可能な資源から得られるため低コストで手に入れることが可能です。しかし機械的特性の制御や生分解性に限界があるなど一定の欠点もあります。
天然由来の様々なバイオマテリアルの中でも、ECM本来の超微細構造と組成を維持した脱細胞化細胞外マトリクスは播種した幹細胞の分化における活用が注目されています。 - ハイドロゲル:ハイドロゲルは生体適合性の高い高分子ネットワークであり、細胞の足場として機能しながら体内の様々な組織の特性を模倣することができます。組織工学のためには、ハイドロゲルが分解して健康な組織だけが残るように、細胞がハイドロゲル構造に取り込まれる必要があります。
ハイドロゲルは大量の水や生体液を吸収して溶けることなく素早く膨潤することができます。水で満たされて膨張した状態では柔らかくゴムのような感触で、生体組織に類似した物理的特性を持ちます。現在、世界中の研究者がハイドロゲルの物理的・化学的特性を変化させ、より優れたハイドロゲルの開発を行っています。近年は「インテリジェント」ハイドロゲルと呼ばれる温度、pH、光、磁場、電場などの外部刺激に応答するハイドロゲルも開発が行われており、組織工学や再生医療への応用に加え、ドラッグデリバリー、創傷治癒、眼科材料など、幅広い用途に広がっています。 - 複合材料:複合材料はマトリックスと呼ばれる連続相と、改質剤と呼ばれる分散相からなる材料の一種です。2つの化合物を組み合わせることで機械的特性の向上や分解速度の制御、生体適合性の向上、生物活性の向上を行うことができます。
構成材料の性質、割合、分布、およびそれらの界面相互作用は、複合材料の特性に影響を与える主要因です。例えばポリマーと無機セラミック材料の組み合わせはポリマー自体の柔軟さと、セラミックの剛性によって優れた機械的特性を有する複合材料が生まれます。そのほか、PLGA/ハイドロキシアパタイト複合体は、硬組織との生体親和性に優れ、高い骨伝導性と生体活性を有しています。
まとめ
組織工学は再生医療などの重要な社会課題に活用することができる技術ですが、その目的を達成するには組織工学の3要素を収束させる必要があります。さらにそれぞれの要素は特定の用途において必要な基準に応じ、適切に変更することが求められます。このように組織工学と再生医療に関連する課題は膨大ですが、幅広い分野で人間の健康を改善するチャンスは計り知れません。
バイオ3Dプリンター技術は、材料を一層ずつ積み重ねることで、複雑で精密な構造物を製作することができ、そのさまざまな製造方法は組織工学の進歩に貢献する大きな可能性を秘めています。TisseuLabs社のバイオ3Dプリンターとハイドロゲルは様々な細胞に必要な条件を備えた構造物をプリントし、組織再生技術の向上に活用いただくことができます。
参考文献
Liu M, Zhou T, Sheets R, et al. WHO informal Almouemen, N., Kelly, H. M. & O’Leary, C. Tissue Engineering: Understanding the Role of Biomaterials and Biophysical Forces on Cell Functionality Through Computational and Structural Biotechnology Analytical Methods. Computational and Structural Biotechnology Journal vol. 17 591–598 (2019). Babensee, J. E., McIntire, L. V. & Mikos, A. G. Growth factor delivery for tissue engineering. Pharm. Res. 17, 497–504 (2000). Cottrill, E. et al. Oxysterols as promising small molecules for bone tissue engineering: Systematic review. World J. Orthop. 11, 328–344 (2020). Chang, H.-I. & Wang, Y. Cell Responses to Surface and Architecture of Tissue Engineering Scaffolds. in Regenerative Medicine and Tissue Engineering (ed. Eberli,D.) (IntechOpen, 2011). Chung, J. J., Im, H., Kim, S. H., Park, J. W. & Jung, Y. Toward Biomimetic Scaffolds for Tissue Engineering: 3D Printing Techniques in Regenerative Medicine. Front Bioeng Biotechnol 8, 586406 (2020). El-Sherbiny, I. M. & Yacoub, M. H. Hydrogel scaffolds for tissue engineering: Progress and challenges. Glob Cardiol Sci Pract 2013, 316–342 (2013). Fodor, W. L. Tissue engineering and cell based therapies, from the bench to the clinic: the potential to replace, repair and regenerate. Reprod. Biol. Endocrinol. 1, 102 (2003). Garg, T., Singh, O., Arora, S. & Murthy, R. Scaffold: a novel carrier for cell and drug delivery. Crit. Rev. Ther. Drug Carrier Syst. 29, 1–63 (2012). Gleeson, J. P. & O’Brien, F. J. Composite scaffolds for orthopaedic regenerative medicine. Advances in Composite Materials for Medicine and Nanotechnology 10, 33–59 (2011).He, Y. & Lu, F. Development of Synthetic and Natural Materials for Tissue Engineering Applications Using Adipose Stem Cells. Stem Cells Int. 2016, 5786257 (2016). Hendriks, D., Clevers, H. & Artegiani, B. CRISPR-Cas Tools and Their Application in Genetic Engineering of Human Stem Cells and Organoids. Cell Stem Cell 27, 705–731 (2020). Hou, P. et al. Pluripotent stem cells induced from mouse somatic cells by small-molecule compounds. Science 341, 651–654 (2013). Lee, E. J., Kasper, F. K. & Mikos, A. G. Biomaterials for tissue engineering. Ann. Biomed. Eng. 42, 323–337 (2014). Li, R. W. et al. The influence of biodegradable magnesium alloys on the osteogenic differentiation of human mesenchymal stem cells. J. Biomed. Mater. Res. A 102, 4346–4357 (2014). Matyash, M. et al. Novel soft alginate hydrogel strongly supports neurite growth and protects neurons against oxidative stress. Tissue Eng. Part A 18, 55–66 (2012). Mantha, S. et al. Smart Hydrogels in Tissue Engineering and Regenerative Medicine. Materials 12, (2019). Murphy, C. M., O’Brien, F. J., Little, D. G. & Schindeler, A. Cell-scaffold interactions in the bone tissue engineering triad. Eur. Cell. Mater. 26, 120–132 (2013). O’Brien, F. J. Biomaterials & scaffolds for tissue engineering. Mater. Today 14, 88–95 (2011). Pires, A. L. R., Bierhalz, A. C. K. & Moraes, . M. BIOMATERIAIS: TIPOS, APLICAÇÕES E MERCADO. Quím. Nova 38, 957–971 (2015). Salinas, E. Y., Hu, J. C. & Athanasiou, K. A Guide for Using Mechanical Stimulation to Enhance Tissue-Engineered Articular Cartilage Properties. Tissue Eng. Part B Rev. 24, 345–358 (2018). Safari, B., Aghanejad, A., Roshangar, L. & Davaran, S. Osteogenic effects of the bioactive small molecules and minerals in the scaffold-based bone tissue engineering. Colloids Surf. B Biointerfaces 198, 111462 (2021). Wang, L., Johnson, J. A., Zhang, Q. & Beahm, E. K. Combining decellularized human adipose tissue extracellular matrix and adipose-derived stem cells for adipose tissue engineering. Acta Biomater. 9, 8921–8931 (2013). Weber, B., Zeisberger, S. M. & Hoerstrup, S. P. Prenatally harvested cells for cardiovascular tissue engineering: fabrication of autologous implants prior to birth. Placenta 32 Suppl 4, S316–9 (2011). Yu, X., Tang, X., Gohil, S. V. & Laurencin, C. T. Biomaterials for bone regenerative engineering. Adv. Healthc. Mater. 4, 1268–1285 (2015).
弊社取扱いの最新型バイオプリンター

TissueStart(ティッシュスタート)
ミクストルーサー式バイオ3Dプリンター
最高のコストパフォーマンスと多様なニーズに対応した
次世代バイオ3Dプリンター

TissueRay(ティッシュレイ) バイオ3Dプリンター
ステレオリソグラフィシステムによる
次世代ハイレゾリューションバイオ3Dプリンター
様々な組織培養に対応可能!消耗品も数多く取り扱いがございますので、ご研究に合わせて、ぴったりの製品をお選びいただけます。

アプリケーションノートをダウンロードいただけます
TissueLabsアプリケーションノートvol.1 「組織工学の三要素」
アプリケーションノート「組織工学の三要素」を公開しております。ぜひダウンロードいただきご研究にお役に立ていただけますと幸いです。
▼ ご質問はご気軽に 下記ボタンよりお待ちしております ▼

