qEV磁気濃縮キット

qEV磁気濃縮キット

※ qEV磁気濃縮キットは基礎的研究目的で使用願います。
臨床、医療行為には使用できません。
qEV磁気濃縮キットは、qEVカラムで精製した細胞外小胞(EV)を濃縮する目的で開発されました。機能化磁性粒子を使用することで、遠心分離や時間のかかるプロトコルを必要とせず、従来よりも迅速かつクリーンにEVを濃縮することができます。
qEV磁気濃縮キットは、スケールアップEV精製システム(PurePath)の一部としてEV診断の基礎研究の利用を目的とした新製品群の一部として開発されました。
高純度な細胞外小胞(EV)を利用してタンパク質・RNA解析へ
qEV磁気濃縮キットは、qEVカラムを使用して高純度に精製された細胞外小胞(EV)を濃縮するためのオールインワンシステムです。
EV の濃縮のために、このキットにはCeres Nanosciences社 のMagnetic Nanotrap ®Extracellular Vesicle Particlesを使用しています。
Magnetic Nanotrap ® 粒子は、磁性コアにコーティングした化学的親和性ベイトで機能化されたハイドロゲルポリマーで細胞外小胞を捕捉します。
バイオマーカー探索に特に適しており、多検体のEV解析を非常に効率よく行うことができます。

Magnetic Nanotrap ® EV Capture Particles を利用して、遠心分離せずに数分で細胞外小胞を素早くペレット化します。
- タンパク質解析 (質量分析法またはウェスタンブロット) や RNA解析 (PCR または RNA シーケンス) など、高濃度に濃縮された EV サンプルまたは少量を必要とするダウンストリームの解析を行う前に、EVを濃縮します。
- 各サンプルに必要なNanotrap ® EV Capture Particles は 20 ~ 70 µL です (カラムのサイズに依存します)。
- qEV磁気濃縮キットは、qEVsingle、qEVoriginal、および qEV1 の qEV カラムで使用するように指定されています。
- 転倒混和のためのチューブローテーター、および磁気チューブラックが必要です。
粒子の結合は不可逆的であり、これは適切なダウンストリーム方法を検討する際の重要な要素です。qEVRNA抽出キットと互換性があります。
内容品:
5 mL のMagnetic Nanotrap® EV Capture Particles
細胞外小胞の濃縮
qEV細胞外小胞精製カラムキットは、他の手法よりも高純度な細胞外小胞を分離するため (図 A)、EV診断に最適な手法となっています。ただ、培養上清と生体液の両方から qEVカラムを使用してEV を精製すする場合、ワークフローの中でEV粒子が希釈される工程があります。
また、一般的な考えに反して、サイズ排除クロマトグラフィー (SEC) ベースの qEVカラムを使用すると、超遠心分離よりも回収率が高く、共沈法と比較して差がない報告もなされています (図 B)。
この報告を見ると分離方法に関係なく、多くのアプリケーションで濃縮が必要となります。
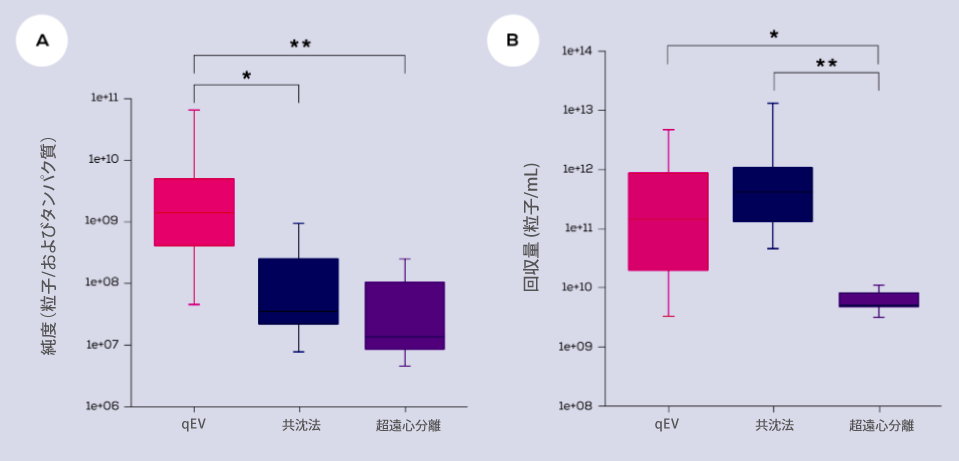
図1 ) qEVカラム、共沈法、超遠心分離を使用して血漿または血清から単離された細胞外小胞 (EV) の純度および回収量の比較。データは文末の1-9の文献から引用されており、統計分析は Kruskal Wallis 検定をしたあとのDunn事後検定により算出しています。データは中央値 ± 四分位範囲 (ボックス) および最小値と最大値 (ひげ) として表示されます(N = 8)。
EVの濃縮手法
EV溶液が大量にある場合は、タンジェンシャルフローろ過(TFF)がEV精製サンプルの濃縮に最適です。
基礎研究で使用されるような少量のサンプルの場合は、遠心濃縮フィルタ (限外ろ過フィルタ) とqEV濃縮キットなどです。
ただし、どちらも時間がかかります。メーカーのプロトコルによれば、限外ろ過フィルタを使用する方法は濃縮完了までに平均75~90分必要です。同様に当社独自のqEV濃縮キット (非磁性) のプロトコルもほぼ同じ時間がかかります。
多くの研究室では問題ないかもしれませんが、多検体のサンプルを分離する場合は生産性が低下し、現実の世界ではバイオマーカーの研究が実行できなくなる可能性があります。さらに、どちらの方法でも遠心分離機が必要なため自動化が制限され拡張性に影響を及ぼします。これらの理由から、私たちは新しいソリューションを開発しました。
わずか20分!短時間・迅速にEV濃縮を
qEV磁気濃縮キットの使用方法は以下の通りです。
①指定量の Magnetic Nanotrap ®粒子を qEVカラムを通したサンプルに添加
②室温で10分間転倒混和混合(チューブローテーターなどで)しながらインキュベート
③強力な磁石を使用してしてEV-Magnetic Nanotrap ® Capture Particle 2分間置きペレット化
④磁石を当てたまま上清を除きます
⑤磁石を除去した後、ペレットを所望の緩衝液中で再懸濁します。
この手順は合計約20分で完了するため、他の方法よりも約4倍速くなります。また遠心分離ステップを必要としないためプロトコルを完全に自動化できる可能性があります。
バイオマーカーを容易に検出
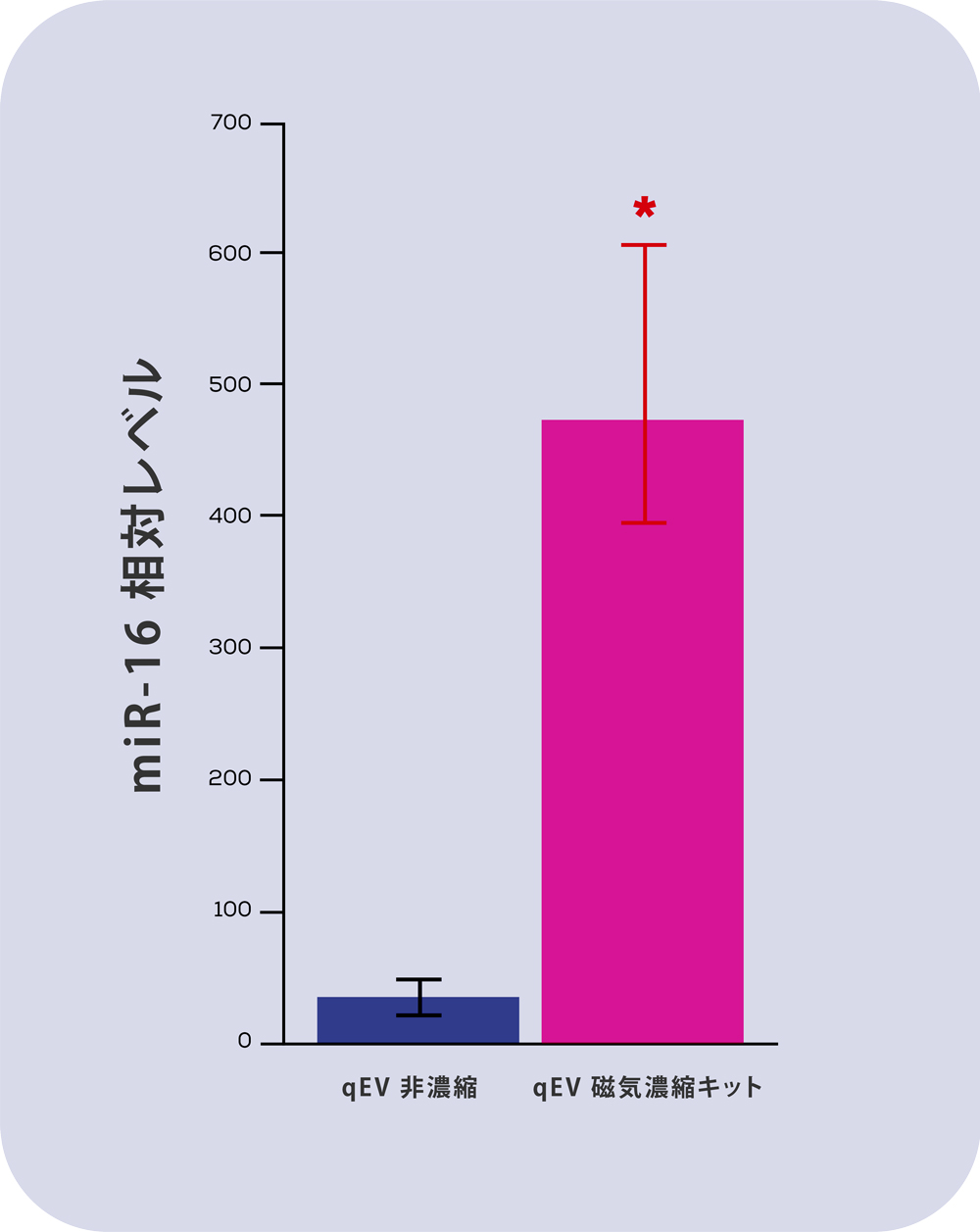
図2) qEV 磁気濃縮キットの濃縮比較:2 つの qEV original Gen 2 カラムからの精製された細胞上清由来のEVサンプルを使用しました。サンプルは均一性を高めるために 2当分し、半分は濃縮せずに、もう半分は qEV 磁気濃縮キットを使用して濃縮しました。同量の未濃縮サンプルと濃縮サンプルをqEV RNA Extraction Kit を使用して RNA 抽出しmiR-16 について qPCR を行った結果です。*p<0.05
バイオマーカー分析がqEV磁気濃縮キットの最も可能性の高いアプリケーションであることを考慮して、濃縮後にEVのmiRNAがどの程度検出できるかを確認しました。
左図に見られるように、qEV磁気濃縮キットでは高いレベルの濃度 (p<0.05) で得られ、問題のマーカーmiR-16が非濃縮サンプルよりもはるかに容易に検出可能になりました。
この検出可能性の向上は、価値のあるEVバイオマーカーが同定に影響を及ぼす可能性があります。
濃縮度は可変であり使用者がコントロールできます。これはqEV磁気濃縮キットでペレット化したサンプルを再懸濁される溶液量で調整します。タンパク質またはRNA分析の場合、選択した溶解バッファーに直接再懸濁することで最も濃縮されたサンプルを得ることができます
どのような目的に適していますか?
qEV磁気濃縮キットを使用すると高濃度に濃縮されたEVサンプルを少量必要とする解析に適しています。例えば核酸分析 (PCRまたはシーケンスなど) およびタンパク質分析 (ウェスタンブロットまたは質量分析など) に適しています。
粒子の結合は不可逆的であるため、qEV磁気濃縮キットはEVの機能分析や細胞治療には適していないことにご注意ください。
この製品についてのお問い合わせ
実際に測定できるか試したい、
操作性を確かめたいなど、
お気軽にお問い合わせください。
▼参考文献
1. Newman, L. A., Useckaite, Z. & Rowland, A. Addressing MISEV guidance using targeted LC-MS/MS: A method for the detection and quantification of extracellular vesicle-enriched and contaminant protein markers from blood. Journal of Extracellular Biology 1, e56 (2022). https://doi.org/https://doi.org/10.1002/jex2.56
2. McNamee, N., Daly, R., Crown, J. & O’Driscoll, L. A method of separating extracellular vesicles from blood shows potential clinical translation, and reveals extracellular vesicle cargo gremlin-1 as a diagnostic biomarker. Translational Oncology 15 (2022). https://doi.org/10.1016/j.tranon.2021.101274
3. Brennan, K. et al. A comparison of methods for the isolation and separation of extracellular vesicles from protein and lipid particles in human serum. Scientific Reports 10 (2020). https://doi.org/10.1038/s41598-020-57497-7
4. Holcar, M. et al. Enrichment of plasma extracellular vesicles for reliable quantification of their size and concentration for biomarker discovery. Scientific Reports 10, 21346 (2020). https://doi.org/10.1038/s41598-020-78422-y
5. Veerman, R. E. et al. Molecular evaluation of five different isolation methods for extracellular vesicles reveals different clinical applicability and subcellular origin. Journal of Extracellular Vesicles 10 (2021). https://doi.org/10.1002/jev2.12128
6. Yang, Y. et al. Extracellular vesicles isolated by size-exclusion chromatography present suitability for RNomics analysis in plasma. Journal of Translational Medicine 19 (2021). https://doi.org/10.1186/s12967-021-02775-9
7. Dong, L. et al. Comprehensive evaluation of methods for small extracellular vesicles separation from human plasma, urine and cell culture medium. Journal of Extracellular Vesicles 10 (2020). https://doi.org/10.1002/jev2.12044
8. Fang, X. et al. A magnetic bead-mediated selective adsorption strategy for extracellular vesicle separation and purification. Acta Biomaterialia 124, 336-347 (2021). https://doi.org/10.1016/j.actbio.2021.02.004
9. Diaz Lozano, I. M. et al. Proteome profiling of whole plasma and plasma-derived extracellular vesicles facilitates the detection of tissue biomarkers in the non-obese diabetic mouse. Frontiers in Endocrinology 13, 971313 (2022). https://doi.org/10.3389/fendo.2022.971313