アプリケーション

■ ナノ粒子の未来を切り拓く最新のアプリケーション公開中
EVアプリケーション
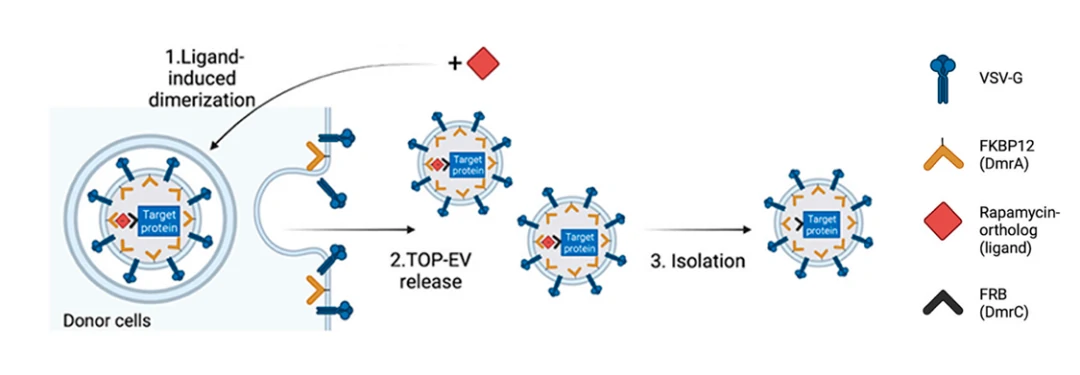
TOP-EVs(Technology Of Protein delivery through Extracellular Vesicles):
細胞内タンパク質輸送プラットフォーム
細胞外小胞(EV)は、直径30〜150nmの二重膜構造を持つ小胞で、生体適合性が高く、低免疫原性かつ天然の標的指向性を持つため、理想的な薬物送達キャリアとされています。しかし、治療薬をEV内部に効率的に搭載し、レセプター細胞に到達後に効果的に放出する方法が課題です。
<薬物の送達方法>
①外部搭載
EVを分離・精製した後、物理的手法(電気穿孔、超音波、凍結融解など)で膜を開き薬物を取り込ませますが、EVの完全性を損ない、送達効率が低下する恐れがあります。
②内因性発現:
細胞内で薬物を発現させてEVに分配する方法です。しかし、膜に共有結合したタンパク質はエンドソームからの脱出が難しく、これまでの研究では標的細胞への送達効率が5%未満とされています。
TOP-EVs プラットフォーム:
オランダ・ユトレヒト大学の研究チームは、「FKBP12」とその変異型「FRB」を利用し、EV表面にVSV-G糖タンパク質を修飾することで、エンドソームからの脱出と細胞内送達を促進する「TOP-EVs (Technology Of Protein delivery through Extracellular Vesicles)」を開発しました。TOP-EVsは、体内外の環境で複数のタンパク質を効率的に送達でき、タンパク質治療薬の発展に寄与することが期待されています。
この成果は、Journal of Controlled Releaseに「TOP-EVs: Technology of Protein delivery through Extracellular Vesicles is a versatile platform for intracellular protein deliver」として発表されました。
ラパマイシンとFKBP12の役割:ラパマイシンは、イースター島土壌中の放線菌 「Streptomyces hygroscopicus」から初めて単離されたマクロライド系化合物で、当初は抗真菌作用、
後に免疫抑制作用が確認されました。FKBP12はラパマイシンと特異的に結合するタンパク質で、哺乳類の多くの細胞で発現しています。
TOP-EVs テクノロジー・プラットフォーム
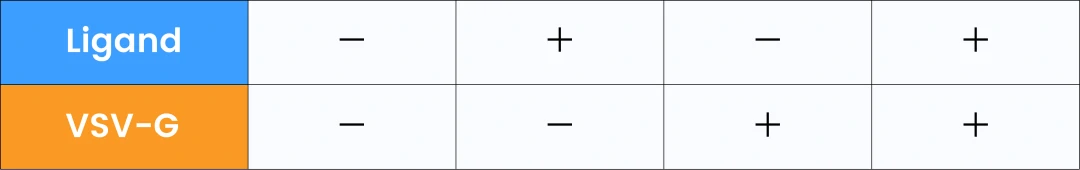
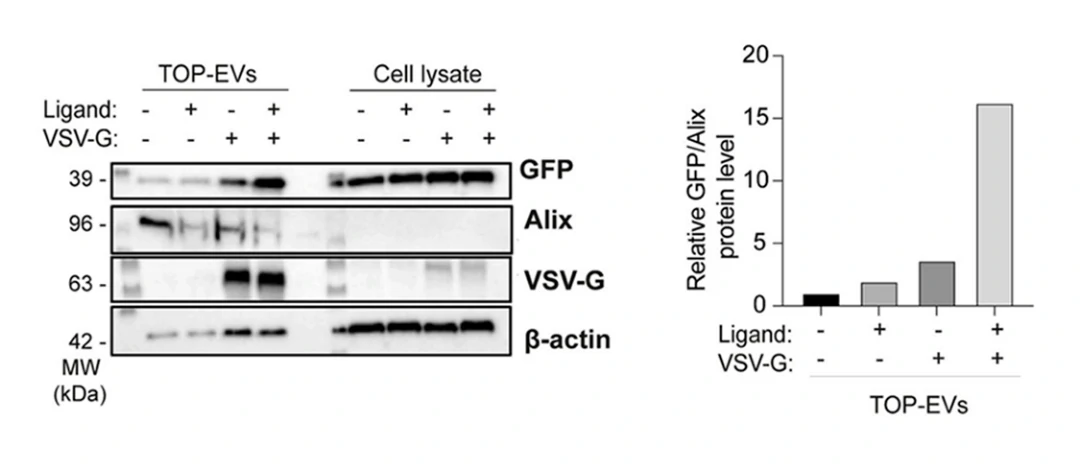
この研究では、VSV-Gとラパマイシン誘導型二量体システムを用いて、タンパク質を効率的かつ可逆的にEVへ搭載する手法が検討されました。GFPをモデルタンパク質として、HEK293FT細胞にVSV-GとGFPを同時にトランスフェクトし、リガンド(ラパマイシン)を添加することで、GFPのEVへの取り込みが促進されることを確認しました。実験結果から、VSV-Gとリガンドの両方がタンパク質のEVへの効果的な搭載に不可欠であることが示され、EVを用いたタンパク質送達の新たなアプローチが提案されています。
NanoFCMでGFPのローディング効率を研究
これらのGFPはすべてのEVに均等に分布しているのか、それとも特定のEV部分集団でのみ過剰発現しているのか。この疑問には、単一粒子を用いて答える必要があります。
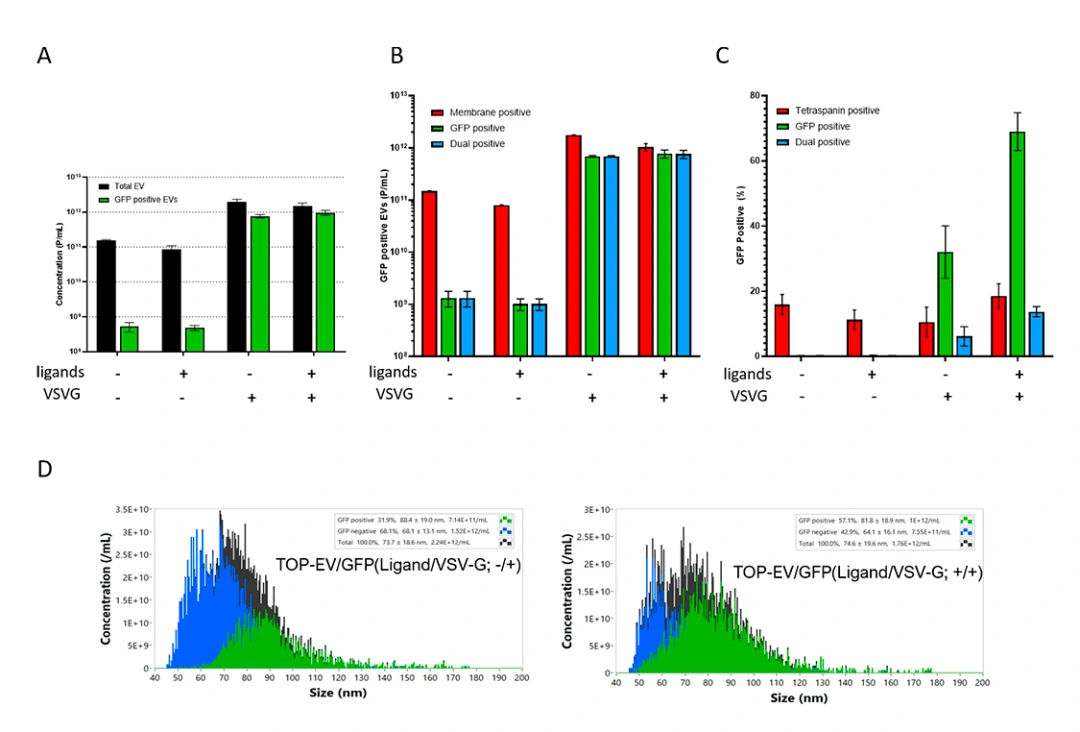
著者らはNanoFCMを用いてTOP-EVsプラットフォームのGFP担持効率を調査しました。図3Aによると、VSV-Gプラスミドを共転写しない場合、GFPを担持したEVの粒子濃度は低いままでしたが、共転写後はGFPのローディング効率が66.2%に達し(表2)、WBの結果と一致しました。EV膜色素MemGlow 640で染色したTOP-EVsの全粒子濃度と膜色素陽性粒子濃度が近いことから、TOP-EVsの純度が高いことが示されました。
また、テトラスパニン(CD9/63/81)を含むTOP-EVsのGFP陽性群体は、11.3%から18.6%に増加し、GFP陽性率はCD9/63/81の陽性率を上回りました。GFP陽性粒子の平均粒子径は、GFP陰性粒子よりも大きく(図3D)、TOP-EVsのGFP陽性率は他よりも有意に高かったため、NanoFCMを使用することで粒子径と機能の相関が明らかになりました。このことから、VSV-Gプラスミドの共導入とリガンドの相互作用が、内在性TOP-EVsのタンパク質負荷と送達を促進するために重要であると結論づけられます。

細胞レベルでのTOP-EVsのGFP伝達効率の検証
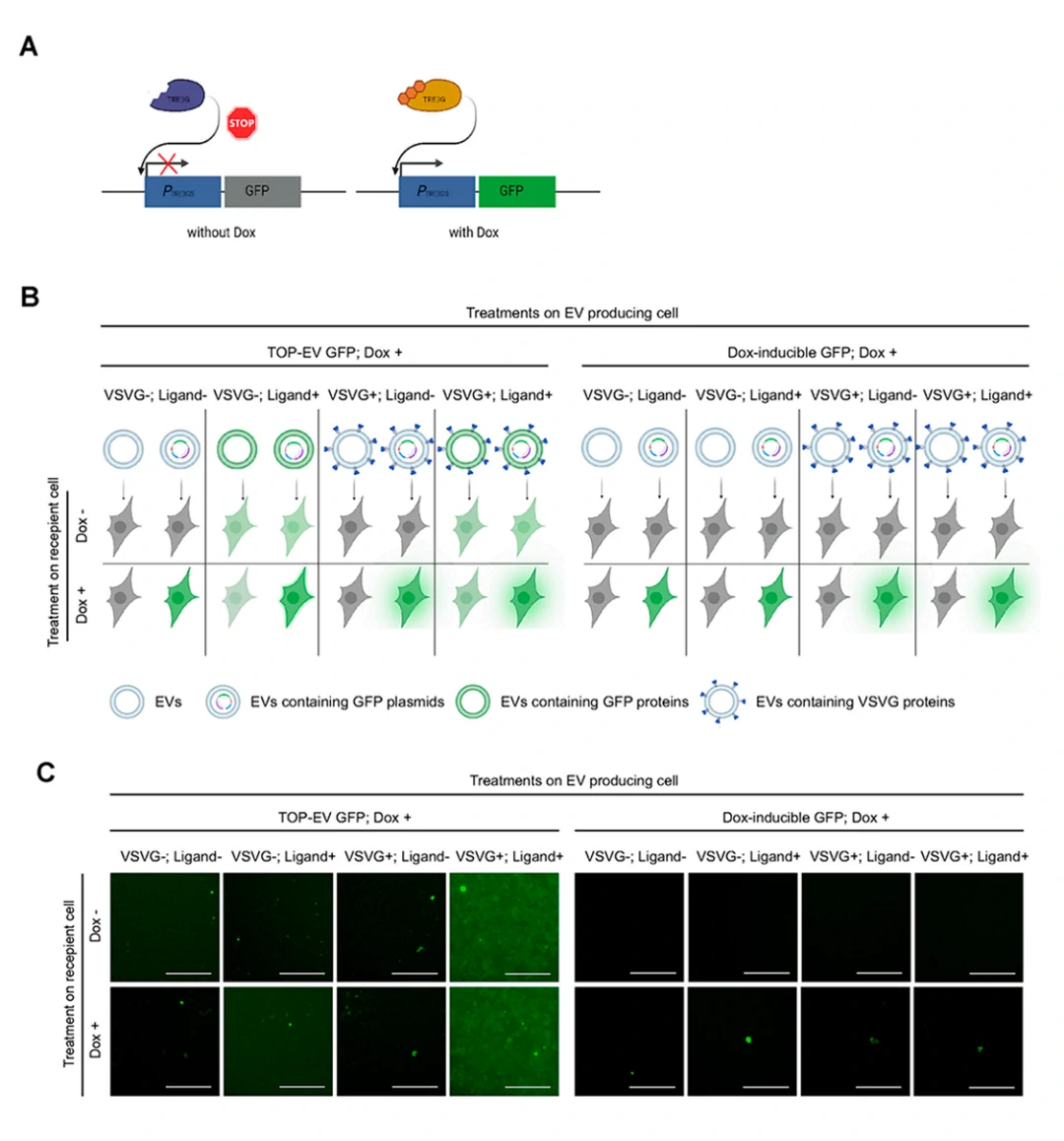
本研究では、TOP-EVsはHEK293FT細胞の瞬時転写によって生成され、著者らは一連の対照実験を設計し、TOP-EVsが直接的な細胞内タンパク質の送達能力を持つことを確認しました。ドキシサイクリン (Dox) 誘導の野生型GFP構築体を使用し、Dox 存在下でTRE3Gトランス活性因子の発現がGFPの発現を促進します。
図4Bでは、著者らが16種類のEV処理戦略を設計し、24時間後に蛍光顕微鏡で観察したところ、GFP TOP-EVs処理を受けた受容細胞のみでGFPが確認され、TOP-EVs(+/+:リガンド/VSV-G)のGFP蛍光強度が最も強かったです。一方、Doxで培養された細胞から生成されたEV処理の受容細胞ではGFPは検出されませんでした(図4C)。この結果は、TOP-EVsが細胞内タンパク質の送達を促進する能力は、分離過程でのプラスミドの直接ローディング時によるプラスミド汚染ではないという著者らの仮説を裏付けるものです。
TOP-EVsの普遍性研究
TOP-EVs送達プラットフォームの普遍性を実証するために、著者らは、TOP-EVsプラットフォームが、in vitro条件下で、Cre組換えプロテアーゼやCRISPR/Cas9リボ核タンパク質複合体(RNP)などの標的タンパク質を送達する能力を拡大し、TOP-EVsを介した細胞内タンパク質送達におけるリガンド/VSV-Gの重要性を検証しました。
つまり、著者らは、TOP-EVs がin vivoで肝臓への細胞内タンパク質の機能的な細胞内送達を仲介する汎用性の高いプラットフォームを開発しました。
要約すると、内因性タンパク質を効率的に担持し、in vivoおよびin vitroでさまざまな標的タンパク質の機能的な細胞内送達を仲介する汎用性の高いプラットフォームを開発しました。
本研究においてNanoFCM(フローナノアナライザー)は、優れた散乱光および蛍光検出性能に基づいて単一エクソソームレベルでのタンパク質(GFP、テトラスパニン(CD9/63/81))および膜構造の標識方法を確立し、TOP-EVsプラットフォーム全体の開発および検証プロセスにおいて重要な役割を果たしました。
この研究はTOP-EVsプラットフォームによって多様な種類のタンパク質における細胞内送達の可能性を提供し、in vitroおよびin vivoアプリケーション向けの機能的なタンパク質送達を媒介する汎用性の高いプラットフォームになることが期待されています。
多能性幹細胞由来の小型細胞外小胞(PSC-sEVs)特異的マーカーの発見とその重要性
小型細胞外小胞(sEVs)は細胞間コミュニケーションを媒介し、再生医療などで重要な役割を果たします。特に、PSC由来のsEVsは老化に関連する変性疾患の治療において大きな可能性を秘めています。しかし、これらのsEVsを特異的に識別する手法が不足していることが、基礎研究から産業応用への進展を妨げていました。
上海交通大学医学院の研究チームは、PSC-sEVsの特異的なタンパク質マーカーをプロテオミクスとNanoFCM技術を用いて初めて同定しました。特に、PODXL、OCT4、Dnmt3a、LIN28A、SSEA4といったマーカーは、他の細胞由来のsEVsと区別するための強力なツールとして機能します。これらの発見は、PSC-sEVsの標準化と品質管理を向上させ、臨床応用への道を開くものです。
また、NanoFCM技術は、単一のsEVレベルでの分析を可能にし、PSC-sEVsの特異的マーカーをより迅速かつ正確に検出できるようにすることで、研究と臨床応用の進展を大幅に加速します。

PSC-sEVのプロテオミクス分析と検証
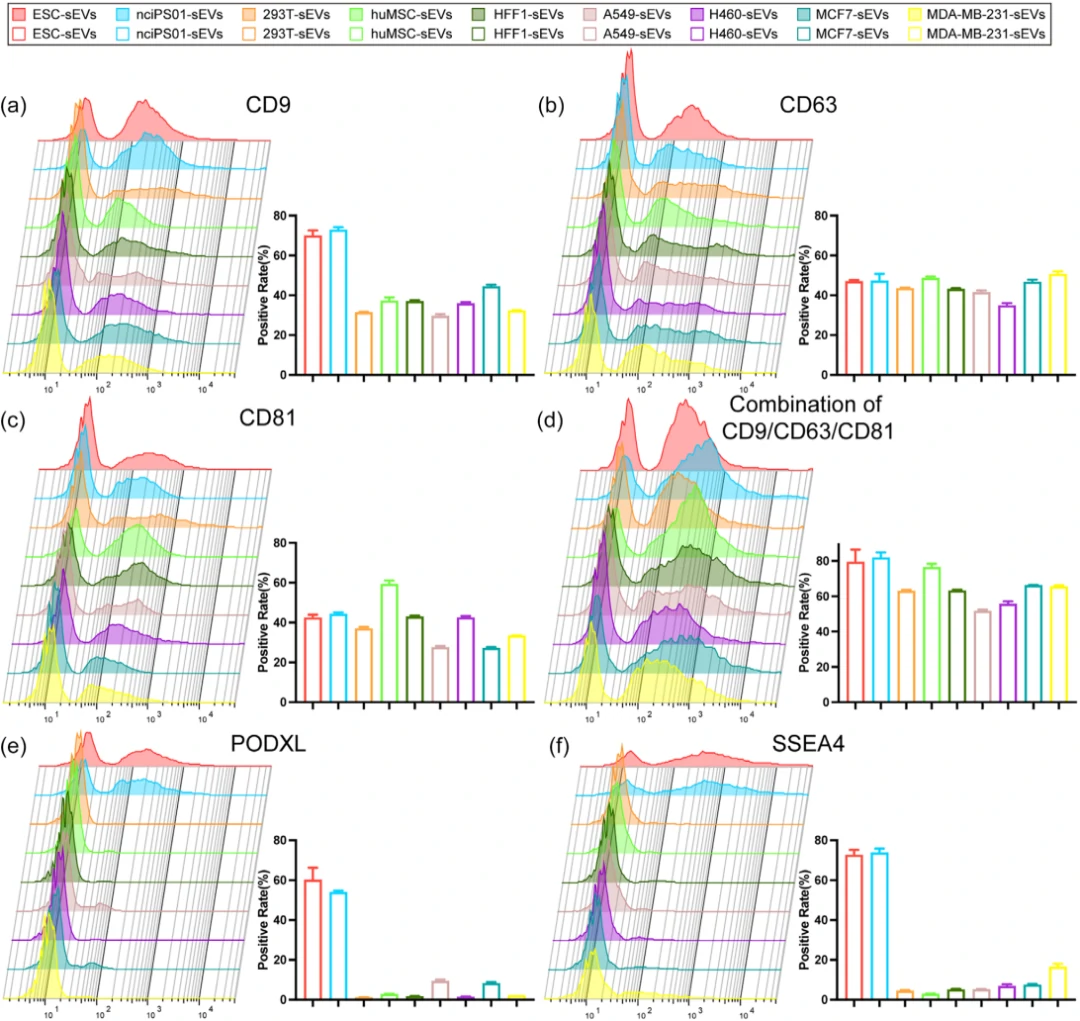
胚性幹細胞(Embryonic Stem Cells, ESCs)および誘導多能性幹細胞(Induced Pluripotent Stem Cells, iPSCs)はいずれも多能性幹細胞(PSCs)に分類されます。この研究では、プロテオミクス解析に基づいて、iPSC-sEVsとESC-sEVsのタンパク質組成をそれぞれ特定しました。
下図1に示されるように、5,000種類以上のタンパク質の中から7種類の多能性に関連する高度に豊富なタンパク質を特定し、ウェスタンブロット法でその存在を検証しました。結果(図1 :g)として、6つのタンパク質(PODXL、YB1、IFITM1、LIN28A、OCT4、Dnmt3A)が異なる多能性幹細胞由来のEVsで明確に豊富であり、多能性幹細胞sEVsのマーカーとしての潜在性を示しました。
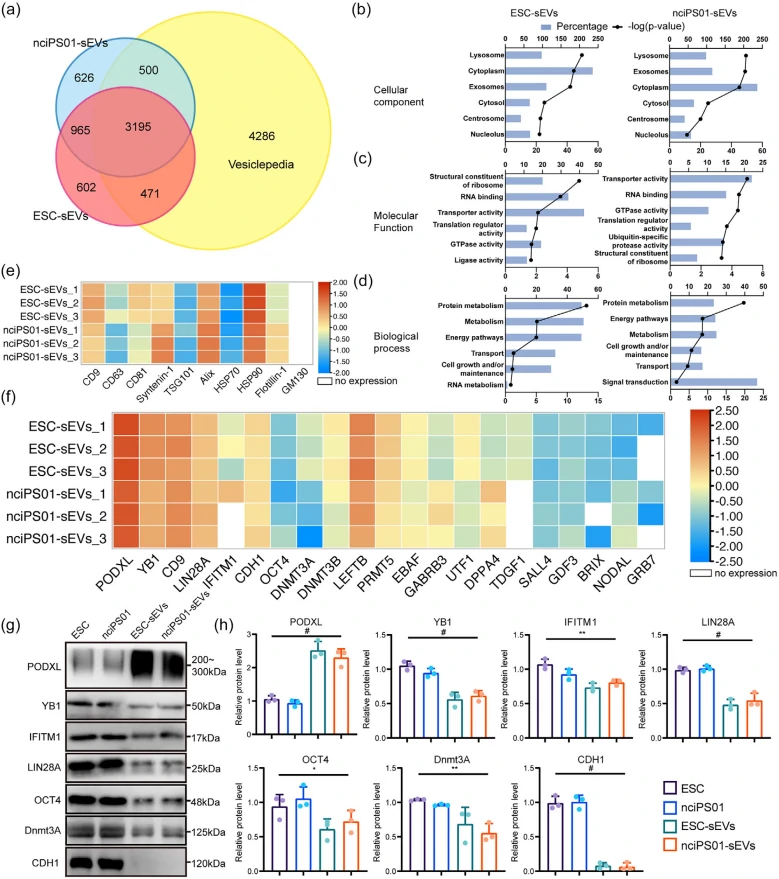
さらに、これらのタンパク質がPSC由来の小型細胞外小胞(sEVs)内で特異的に発現しているかどうかを調査しました。7種類の非多能性細胞(293T、HFF1、huMSC、A549、H460、MCF7、MDA-MB-231)から得られたsEVsを分析した結果、Western BlotではLIN28A、OCT4、Dnmt3aは7種類の非PSC由来のsEVsには発現しておらず、YB1とIFITM1は4種類の非PSC由来のsEVsにおいて検出されました。PODXLはMCF7由来およびMDA-MB-231由来のsEVsで検出されましたが、PSC由来のsEVsとは異なる位置にバンドが現れました。そのため、PODXLもPSC由来のsEVsと非PSC由来のsEVsを有効に区別するために利用できると考えられます。したがって、これらの4つのタンパク質(PODXL、OCT4、Dnmt3a、LIN28A)はPSC由来のsEVsの特異的な同定と品質管理に使用できるとされます。
単一PSC-sEVレベルでの特異的マーカー分析
EVsの異質性により、著者らは、NanoFCMを用いて単一小胞レベルでのマーカーの特異性を検証しました。PSCと7種類の非PSC由来のEVsで、CD9、CD63、CD81、膜蛋白PODXL、表面糖脂SSEA4の発現を調査しました。CD9はPSC-sEVsで60%以上の陽性率を示し、CD63とCD81にはPSC-sEVsと非PSC-sEVs間に有意な差はありません。PODXLとSSEA4はPSC-sEVsでそれぞれ50%と70%以上の陽性率を示し、非PSC-sEVsでは1%から18%にとどまりました。蛍光共焦点顕微鏡での観察も一致し、PODXLとSSEA4はPSC-sEVsの特異的マーカーとして有望です。
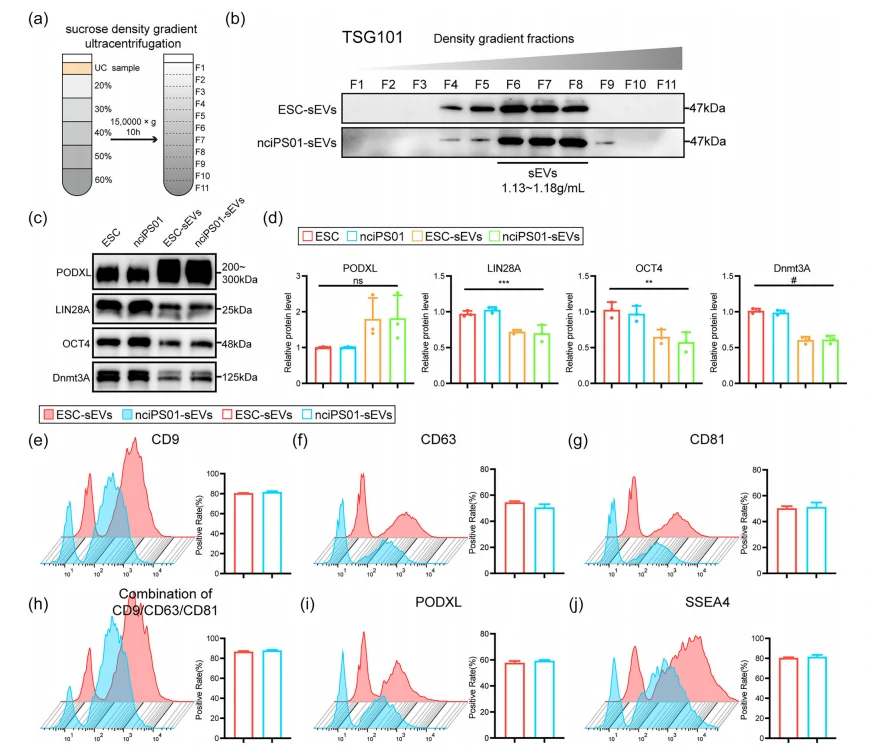
密度勾配遠心分離(DGUC)で精製されたPSC-sEVsのマーカー検証
超遠心法で精製したEVsサンプルに非小胞成分が含まれている可能性があるため、密度勾配遠心分離(DGUC)を用いてサンプルをさらに精製しました。結果、PODXL、OCT4、Dnmt3a、LIN28Aのタンパク質がDGUCで精製されたEVsに豊富に含まれており、これらのマーカーは汚染物質由来ではないことが確認されました。NanoFCM分析でも、DGUC精製sEVsのCD9、CD63、CD81、PODXL、SSEA4の陽性率は超遠心法によるEVsと類似しており、マーカーの汚染物質由来や純化方法の違いによる影響は排除されました。
この研究では、初めて一群のPSC由来の小型細胞外小胞(sEVs)の特異的マーカー(PODXL、OCT4、Dnmt3a、LIN28A、SSEA4)を同定しました。これらのマーカーはPSC-sEVsの同定と品質管理に使用でき、PSC-sEVsの臨床応用において重要な価値があります。
幹細胞由来のEV療法の研究と応用において、NanoFCMは優れた散乱と蛍光検出性能により、単一小胞レベルでの異なる豊富さのタンパク質マーカー分析を実現し、幹細胞EVの特異的マーカー特定に貢献します。これにより、分析時間が大幅に短縮され、基礎研究と臨床転化が加速されます。
単一EVの量的・多パラメータ分析
フローサイトメーターは液中の細胞および微小粒子におけるハイスループット、マルチパラメータ、定量分析のための確立された技術ですが、従来型のフローサイトメーターでは最小で150nm程度までの粒子しか測定することができず、EVの評価という点では検出サイズにおいて課題がありました。
NanoFCM フローナノアナライザーは散乱光を使用した独自の解析手法により、 直径40〜150nmにおけるEVの多パラメータ分析に対応し、なおかつ単一蛍光を十分に検出することができます。さらにNanoFCMのソフトウェアにおいては蛍光粒子と非蛍光粒子のゲーティング解析によってそれぞれのサイズ、濃度、全粒子に対する割合を容易に解析することが可能です。
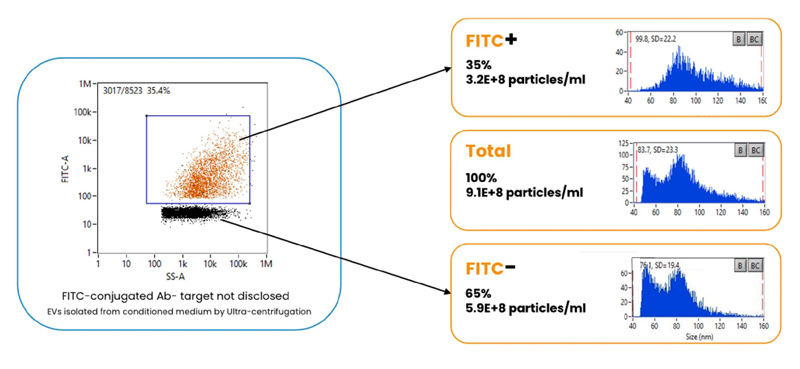
EV存在量の定量化
NanoFCMは単一分子レベルで検出できる高感度センサー(SPCM)を搭載しており、EV表面のテトラスパニンや内在する核酸の蛍光シグナルを高感度に検出します。
EV 1 粒子ごとの内在性蛍光や標識蛍光の両方を計測し、蛍光EV集団と非蛍光集団の割合や、それぞれのサイズ・濃度を絶対値で解析することが可能です。
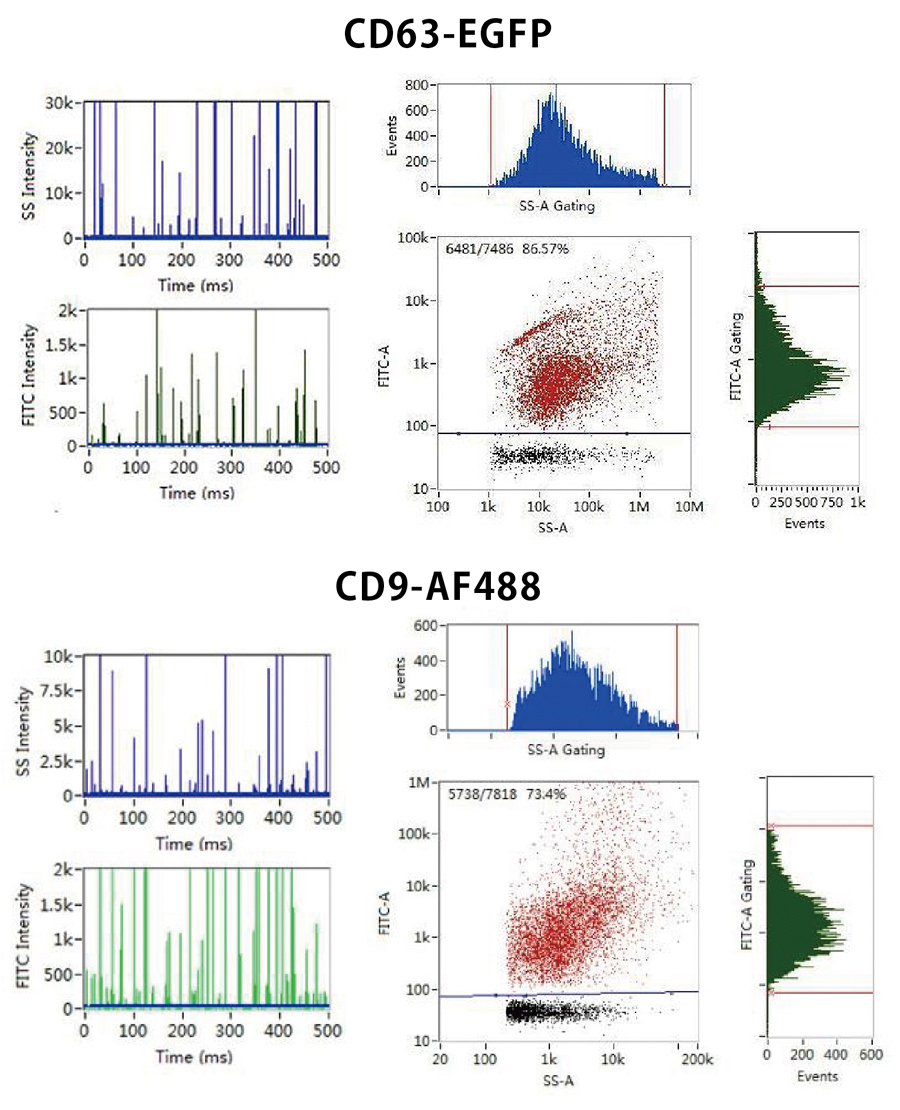
EV内のmiRNA量の評価
EVは内部および表面にRNA、DNA、タンパク質、脂質、および代謝産物を含んでおり、物質を解析することによってEVがもたらす機能を評価することができます。
NanoFCMはタンパク質、核酸、脂質も蛍光染色によって検出し、単一粒子スケールでの評価を可能にします。さらに蛍光シグナル強度からその存在量を解析し、EV 1 粒子においての表現型決定(フェノタイピング)を可能にします。
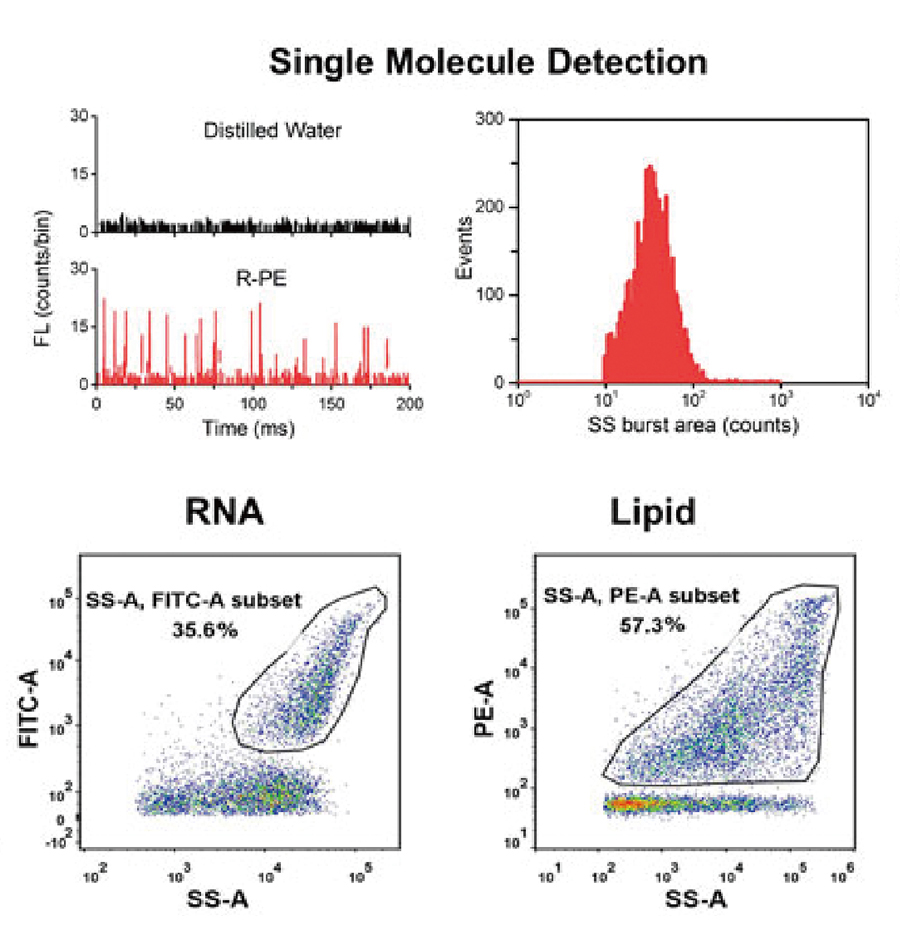
FITCシグナルによってEV内部に存在するRNAの存在割合が、PEシグナルによってベシクルの存在割合が確認できます。
蛍光標識されたEVと非蛍光粒子の識別によってサンプル中にターゲット粒子が存在するか判断することもできます。
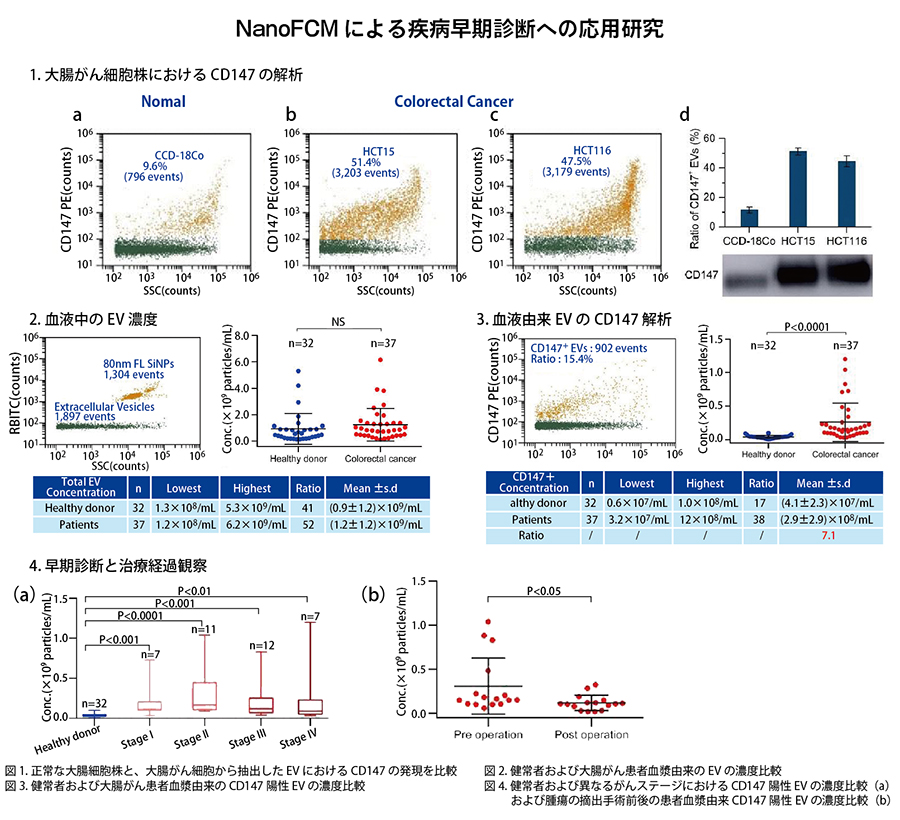
疾病早期診断への応用
細胞外小胞(EV)はその遺伝子情報から疾患の証拠となることが様々な研究から示唆されています。 NanoFCMは、単一EVの側方散乱光と蛍光信号を同時に取得し、EVの全サイズレンジの計測も可能であることから、特異的な抗原に対する蛍光標識を行ったサンプルの分析により、癌などの疾患において非侵襲的早期診断が実現可能となります。
NanoFCMはEV全領域における単一粒子解析と表面タンパク質の蛍光解析を両立させたフローサイトメトリーであり、EVの診断および治療の可能性を評価するための強力なツールです。
ウイルス・ワクチン・ウイルスベクター
アプリケーション
二波長レーザーによる単一ウイルスのラベルフリー検出
地球上に最も多様に存在するウイルスは、我々の生活に大きな影響をあたえています。 しかし、主に直径20~200nmと、ウイルスのサイズが小さく、構造が単純であるため、200nmを超える粒子がターゲットとなる従来のフローサイトメトリーでは、ウイルスの検出は難しい場合があります。
動物感染ウイルスは、多くの致命的疾患の原因となり、植物感染ウイルス病原体は、世界中の作物の病害のもとになる一方、ウイルス遺伝子治療ベクターとして、多くの生物学の研究に利用されております。NanoFCMは直径27nmのレビスウイルス由来のシグナルをバックグラウンドノイズから分離しており、この結果はNanoFCMが自然界に存在するほとんどのウイルスナノ粒子の検出要求を満たす可能性を示しています。
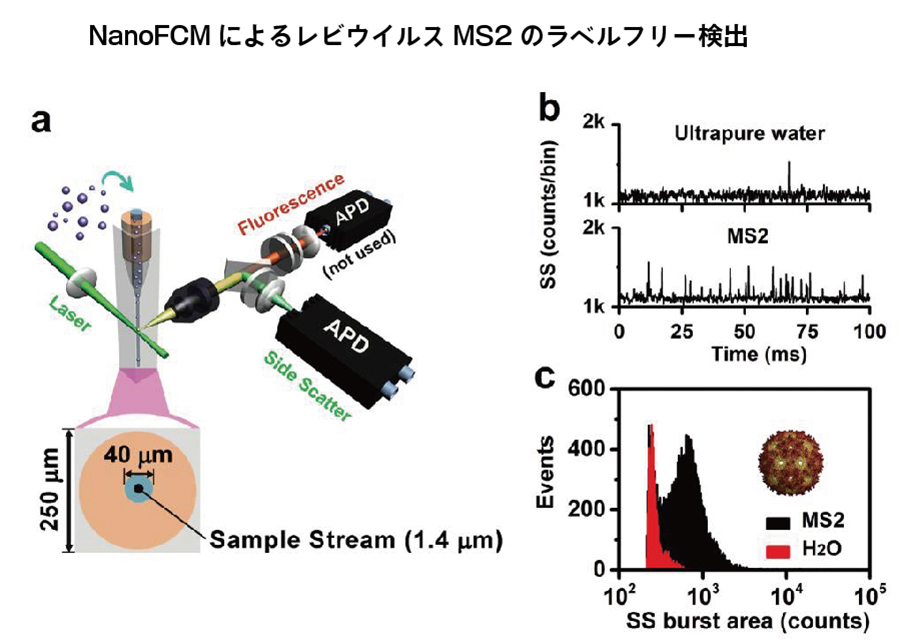
1分間に検出されたすべてのナノ粒子の平均シグナル強度とバックグラウンド信号(ノイズ)の標準偏差から算出したS/N比は11であり、NanoFCMはバックグラウンドノイズに対してMS2ウイルスを高い感度で識別可能であることを示しています。
COVID-19ワクチンの品質管理
バイオ医薬品産業においてワクチン製造をはじめとする多くのバイオテクノロジー分野では、ウイルス製剤の純度評価が不可欠です。ウイルス製剤の調製過程では、宿主細胞の溶解液中に、細胞の残骸、空のキャプシド、成熟したビリオンなど、多くの粒子が共存することがあり、高い有効性を維持するためにはその安定性を長期的に追跡することが不可欠となっています。
下図では、不活化コロナウイルスから作られたCOVID-19ワクチンについて解析しています。新規コロナウイルス1個のサイズ(直径)分布と粒子濃度は、NanoFCMのソフトウェアから直接取得することができます。さらにNanoFCMは高いサイズ分解能と蛍光フェノタイピングによりウイルス粒子の均一性とウイルス粒子純度を評価することもできます。 NanoFCMの解析プラットフォームは、単一のコロナウイルスの定量的かつ多項目解析を可能にし、高感度かつハイスループットなCOVID-19ワクチンの品質管理に大きな可能性を示しています。
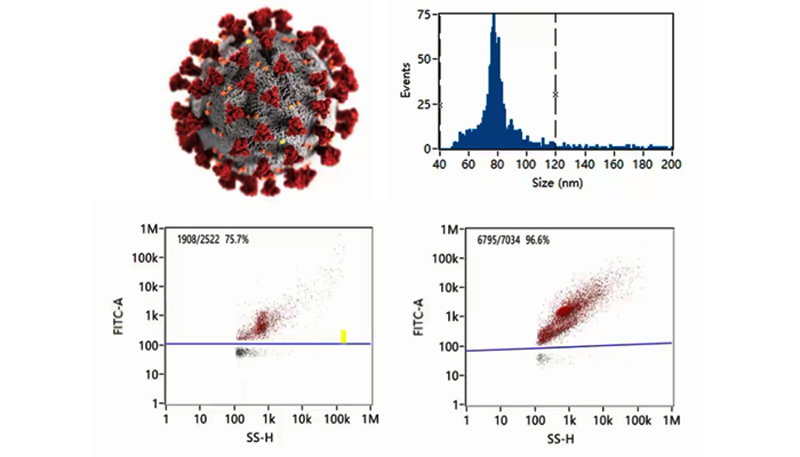
FITCにより蛍光標識された不活化コロナウイルスは数回の精製工程を経てほぼ100%まで上昇
細胞・遺伝子治療用レンチウイルスの包括的な分析
B細胞悪性腫瘍に対するCAR-T細胞療法は、がん治療として初めて米国食品医薬品局(FDA)に承認された細胞療法です。CAR-T細胞療法で最も広く使用されているベクターは、レンチウイルスでありこのレンチウイルスの包括的な特性評価は、CAR-Tの構築を成功させるために非常に重要です。
レンチウイルスのサイズ分布は直接光散乱検出によって推定しました。RNAは膜透過性核酸色素を使用して標識し、VSV (Vesicular Stomatitis Virus)-Gタンパク質は蛍光標識モノクローナル抗体によって特異的に認識しました。これによりRNAシグナルとVSV-Gシグナルの両方を持つ粒子は有効なレンチウイルスベクターとして同定されます。 レンチウイルスベクターの核酸とタンパク質の同時解析により、培養条件を最適化してウイルスを最大限に生産するだけでなく、カプセルタンパク質を効果的に発現するウイルス株をスクリーニングすることも可能です。
※VSV-Gタンパク質:Vesicular Stomatitis Virus Gタンパク質
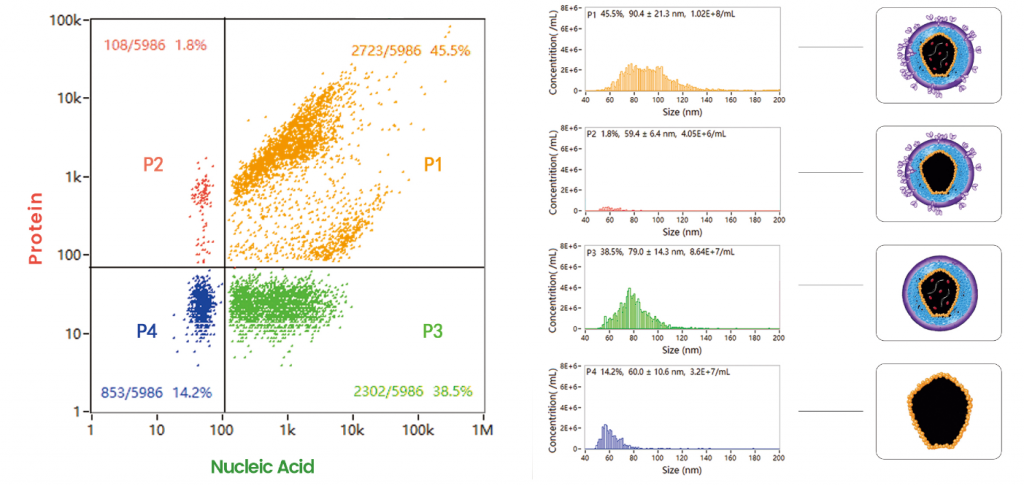
ウイルスの品質管理によるCAR-T療法の普及や応用の加速
Nano FCM フローナノアナライザーは、レンチウイルスの濃度や純度を直接測定できるほか、研究開発から製造、精製、品質管理まで、レンチウイルス製造の全工程に適用でき、レンチウイルスの大量生産を容易にし、CAR-T療法の普及・応用を加速させることが可能です。
腫瘍治療のためのがん溶解性アデノウイルス
Oncolytic Viruses(オンコリティックウイルス)とは複製能力を持つ殺腫瘍性ウイルスの一種であり、標的細胞の腫瘍抑制遺伝子を不活性化して腫瘍細胞に選択的に感染し、その細胞質で自己複製を行い、最終的に腫瘍細胞を死滅させ、同時に免疫反応を刺激し、より多くの免疫細胞を引き寄せて、残存するがん細胞を殺し続けるという特異的な性質を有しています。
特に腫瘍溶解性アデノウイルス(Oncolytic Adenoviruses:OA)は、前臨床試験および臨床治療の両方で検討されているが、標的への到達性が低いことがOA応用を制限する大きな障害となっている。ここではOAを標的リガンドで遺伝子操作されたバイオエンジニアリング細胞膜ナノベシクル(BCMN)で装飾したことで得られたOA@BCMNは、複数の異種移植モデルにおいて標的送達の強化、ウイルスへの影響性、生存率への有効性を示しました。
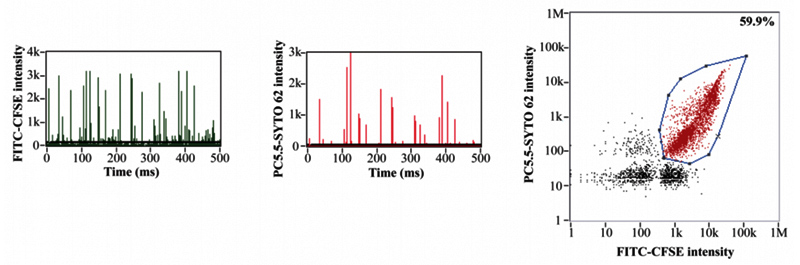
第一世代計測技術(TEM, NTA)との比較
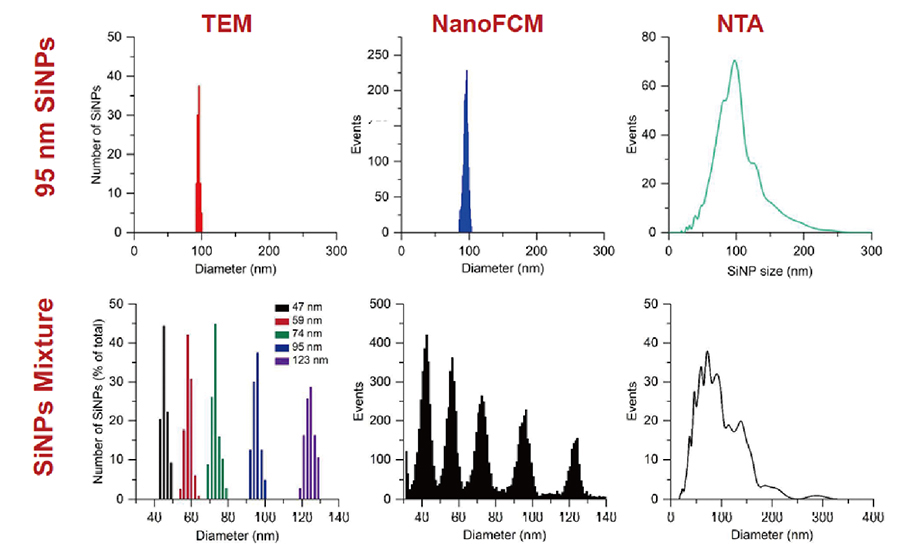
【上図】95 nmシリカナノ粒子の比較測定の結果です。 NanoFCMはサイズ評価で信頼性が高いTEMと結果が一致します。NTAは20-250 nmのブロードな分布結果です。
【下図】サイズが異なるシリカナノ粒子(47, 59, 74, 95, 123 nm)をミックスし測定しています。 NanoFCMはTEMと相関性が非常に高い高分解能な粒度分布結果を得ることができます。
LNPアプリケーション
ナノサイズ医薬品のための包括的な測定
現在ナノメディシンは脂質ナノ粒子(LNP)、高分子ナノ粒子、無機ナノ粒子、ウイルスナノ粒子に分類されています。その中でも、リポソーム、固体脂質ナノ粒子、脂質ミセル、細胞外ベシクルなどの脂質ベースのナノメディシンは高い生体適合性と実質的な薬物負荷能力という利点を示し、最も成功した薬物送達システムとして考えられています。
NanoFCM フローナノアナライザーの優れた分解能や、高感度、高速検出、マルチパラメーター分析機能は、LNPにおける粒子径、薬剤含有量、薬剤封入効率、粒子濃度、表面リガンド密度を単一粒子レベルで決定できることから、ナノメディシンの包括的な特性評価プラットフォームとしてご活用いただけます。
サイズ&濃度のラベルフリー解析
LNPが核酸医薬やmRNAワクチンのナノキャリアとして使用される場合、その粒子サイズは自然免疫刺激およびナノ粒子の組織および細胞分布に影響を与え、粒子濃度はナノメディシンの最終的な治療効果に直接影響する重要なパラメータです。
NanoFCMはこれらのナノメディシンのサイズ分布と濃度をラベルフリーで分析することができます。
本測定でサンプルとして使用したmRNA-LNPは(図1.)に示すように40-200nmの粒度分布を持ち、サイズの中央値は97 nmでした。
また、このサンプルの粒子濃度は単粒子測定法では 3.11E+11 particles/mL であり、この結果を検証するために同一サンプルに対して複数の希釈系を測定することで結果の検証を行っています。(図2.)
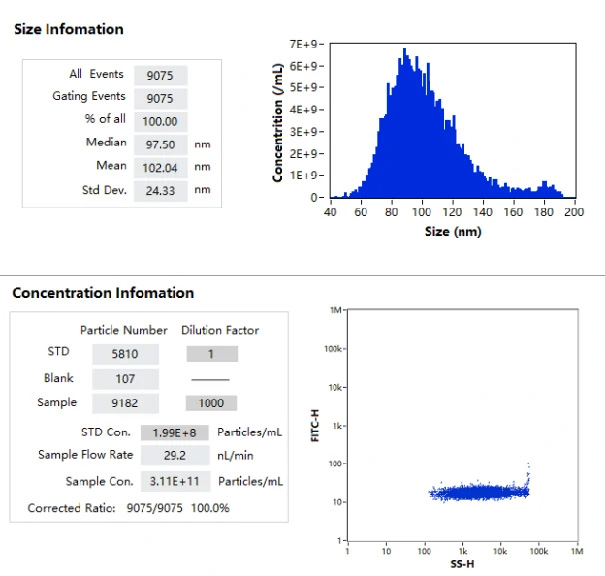
図1.mRNA-LNPのサイズ分布および濃度測定
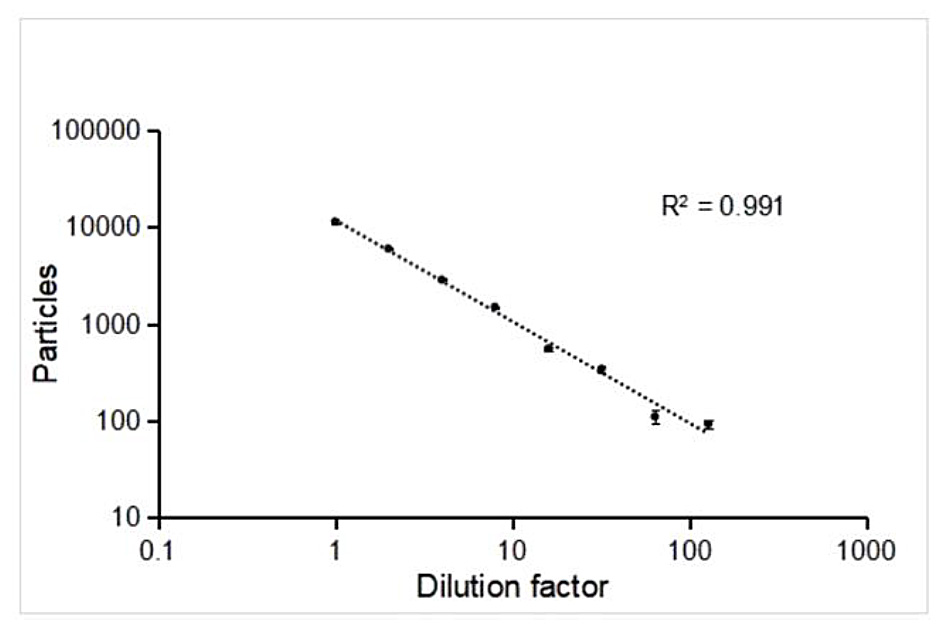
図2. 段階的希釈によるmRNA-LNPの濃度解析
サンプルを1~100倍まで段階的に希釈し、NanoFCMによって検出された粒子個数をプロットしています。
LNP負荷粒子比率
カチオン性脂質は核酸をカプセル化しエンドソーム脱出を促進するため、核酸医薬の合成工程において広く用いられていますが、カチオン性脂質上の電荷の存在が毒性につながるため、すべての粒子に対してより効果的にmRNAを搭載し、その評価を行うことが重要となります。
また、RNA干渉(RNAi)の手段としてsiRNAを内包したLNPが検証されていますが、その利用においては正確な粒子数および担持粒子の割合や比率を求める必要があります。
NanoFCMはSPCMモジュールによる優れた光散乱感度により、サンプル中に存在するほとんどすべてのLNPを検出し、核酸染色を使用して蛍光検出を行うことにより、粒子の負荷割合と治療薬のカプセル化効率を評価することができます。
ここでは、NanoFCMを使用して、Alnylam Pharmaceuticals (米国マサチューセッツ州ケンブリッジ) が調製したsiRNA LNPおよびコントロールとなるEmpty LNPについて特性評価を行いました。
サンプルは細胞透過性核酸染色色素のSYTO82とインキュベートし、LNP内部の核酸を標識しています。 測定の結果、(図3.)に示すように、Empty LNPとsiRNA LNP は蛍光シグナルに基づいて容易に識別でき、この結果を用いてそれぞれの集団定量評価することができます。
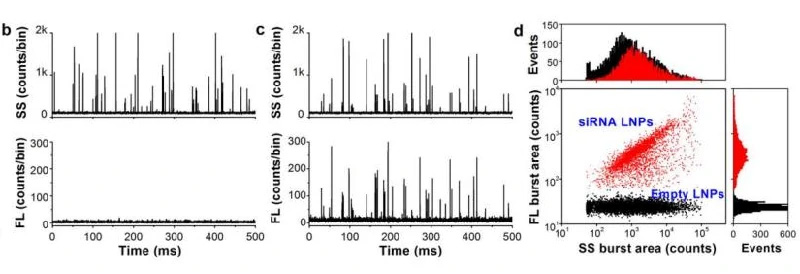
図3. siRNAの有無によるLNPの定量評価
(b,c) LNPサンプルの側方散乱光(SS)および蛍光(FL)シグナル。
それぞれ (b)siRNAがロードされていないLNP(c)siRNAがロードされたLNPを示しています。
(d)LNPサンプル(b,c)の混合物におけるSS-FLの2変量解析ドットプロットを示しています。
また別の研究では、異なるLNP合成試薬を用いて製造した2種類のmRNA-LNPにおけるmRNA担持率を評価しました。
各サンプルには同一の蛍光標識を行いNanoFCMで解析を行った結果、それぞれ97.7%と90.3%の割合でmRNAがLNPにロードされていることが確認されました(図4.)。また、これら2つのサンプルにおいて、Y軸に示した担持画分の定量結果と蛍光の相対強度から、各サンプルの違いを評価することも可能です。
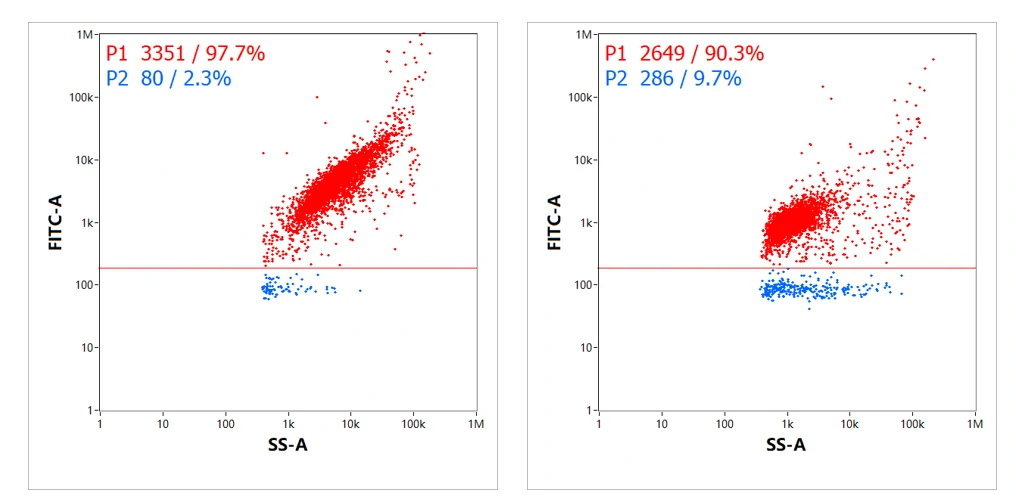
図4. 製造方法が異なる2種類のmRNA-LNP測定
蛍光強度(FITC-A)はドットプロットのY軸に沿って示されており蛍光染色されたRNAの量を示しています。
ドットプロットの分散状態からもそれぞれのサンプル特性を評価することができます。
LNP内在のmRNAコピー数の解析とカプセル化効率
NanoFCMの測定においてmRNA-LNPを細胞透過性核酸染色試薬で標識すると、mRNAを担持しているLNPと遊離mRNA由来のシグナルが蛍光チャンネルにおいて識別されます。このとき得られた微小な蛍光シグナル(図5. 矢印)に対して、蛍光標識された純粋mRNA分子(図6.)を対照とする解析を行った結果、ここで得られた微小な蛍光シグナルは単一の遊離mRNA由来のものであることが確認されました。
また、NanoFCMの解析プラットフォームにおいてFITCシグナルとSSシグナルの2変量解析プロットに対してFLトリガーを適用することより、遊離mRNAとmRNA-LNPのクラスタを表示することができます(図5.右)。この測定結果より、mRNAは溶液中で遊離した状態と、LNP内に内包された状態の2つの状態で存在することがわかります。また、カプセル化効率= LNPに内包されたmRNAの量 /カプセル化された mRNAと遊離mRNAの総量、とすると、(図5.)と(図6.)に記載されたサンプルにおけるmRNAのカプセル化効率は80.5%と決定されました。
さらにヌクレオチド数と蛍光強度の線形相関を取り、各LNPの蛍光強度を単一遊離RNA分子の蛍光強度で割ることで、LNPあたりの内包RNAコピー数を定量化することができます(図7.)。
この例において、LNP 1粒子あたりに内包されているmRNAのコピー数の中央値は約12 mRNAと解析されました。 カプセル化されていないmRNAは不安定な状態であり体内で分解されるため、WHO(世界保健機関)においてmRNAのカプセル化の程度は重要な品質属性とみなされるべきであると強調されています
このようにNanoFCMの解析プラットフォームにおいてmRNA-LNPのデータを解析すると、mRNAを担持しているLNPの存在割合を算出すると共にサンプルのカプセル化効率を決定することができます。
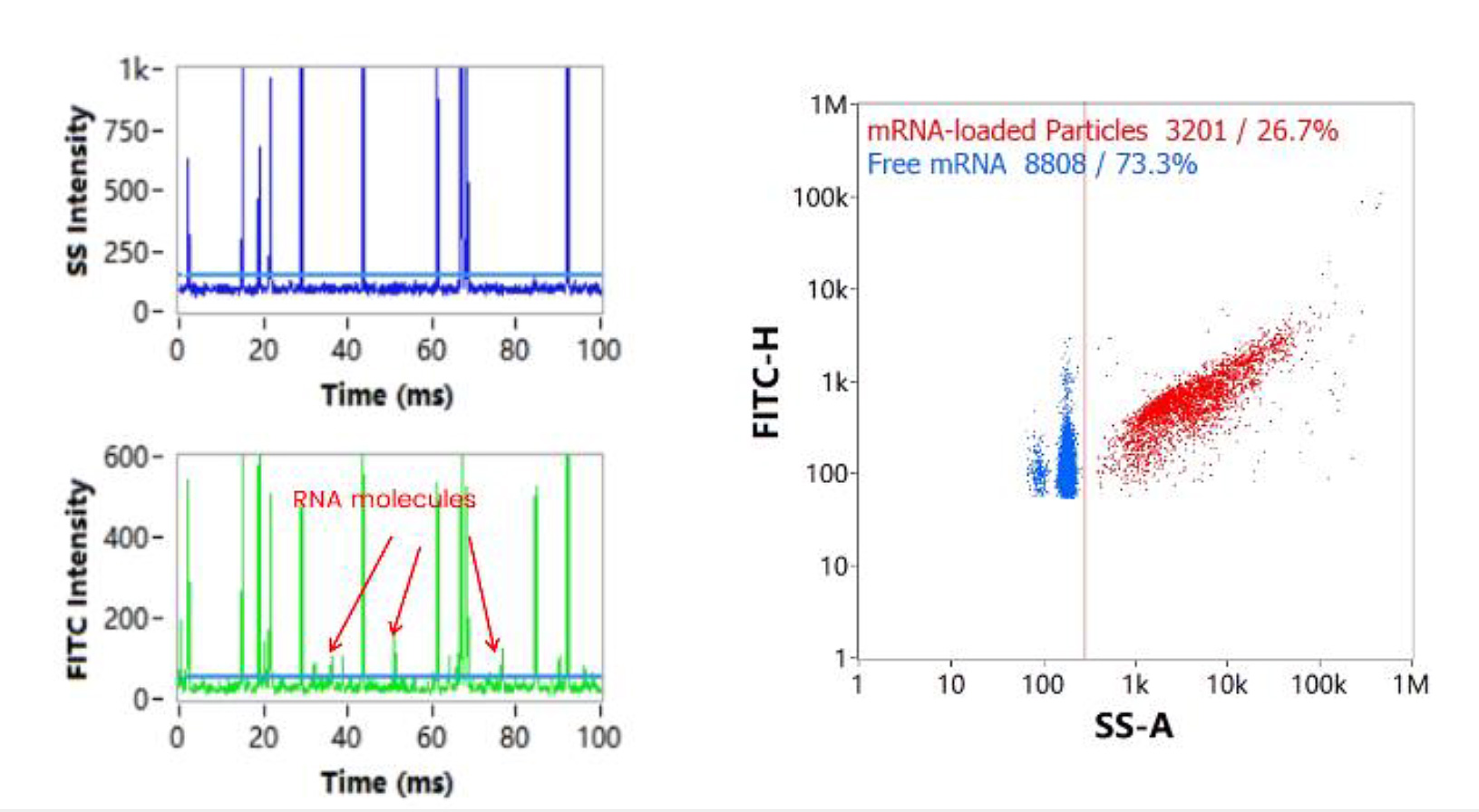
図5. mRNA-LNPの解析と遊離mRNA検出
FITCチャンネルにおいて側面散乱が検出できない小さな粒子(遊離mRNA)由来の蛍光シグナルが検出されています。
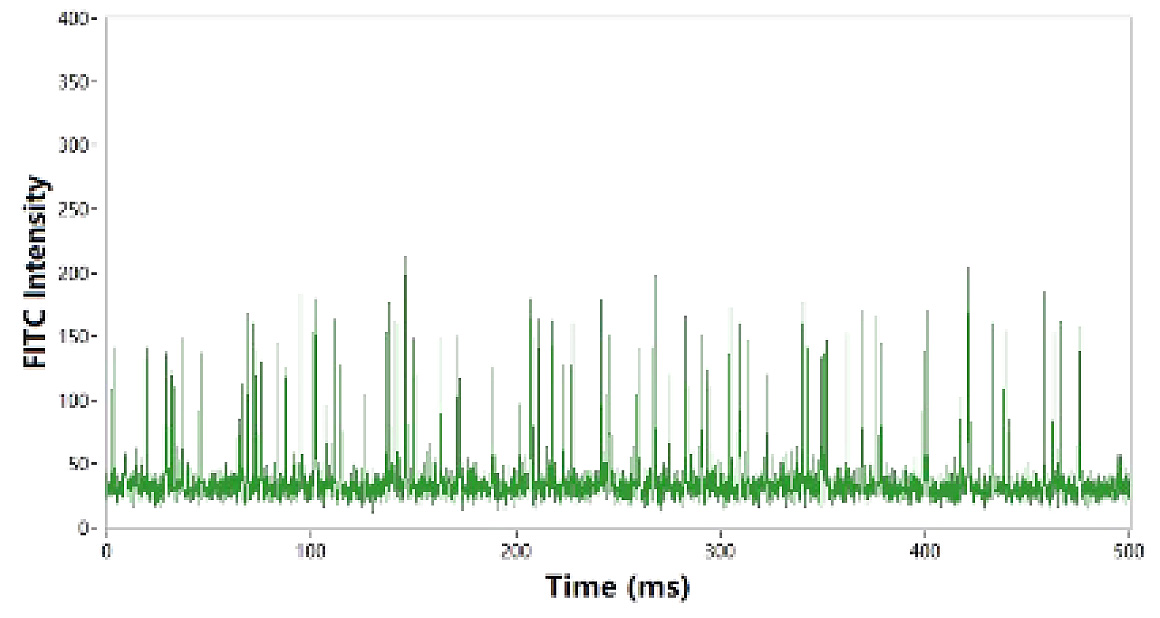
図6. 遊離mRNAの蛍光測定
蛍光標識された純粋mRNA分子の蛍光強度は約100程度であり、図5.の矢印で示す蛍光シグナル強度と近しい値が得られています。
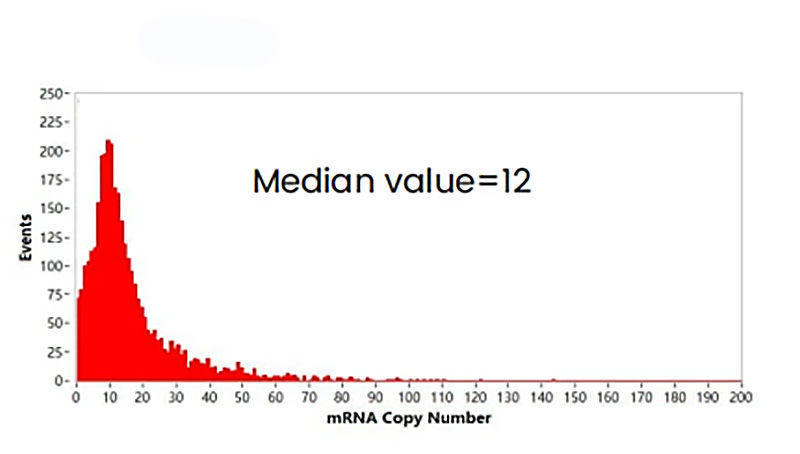
図7. mRNAコピー数の分布
検出されたmRNA-LNPの蛍光強度を単一遊離mRNA分子の蛍光強度で割ることで、LNPあたりの内包RNAコピー数を定量化することができます。このデータではLNPあたりのコピー数の中央値は12 mRNAです。
核酸の局在アッセイ
mRNAワクチンのサブポピュレーション解析
mRNA-LNP製剤には3つの主要なサブポピュレーションが存在し、それぞれ(図8.)に示されるVaccine(P1、赤)、Non-loaded Vaccine(P2、青)、Free RNA(P3、黄)とに区別することができます。実際にmRNAワクチンを模式したmRNA-LNPサンプルを細胞透過性の核酸染色色素で標識したものを測定し、SS-FLデュアルトリガーを使用して、3つの集団を1つの図に示すと各サブポピュレーションにおける濃度割合は44.0%,1.7%,52.7%となります。
このサンプルに対してRNase処理をすると、Free RNAであるP3の集団が消失しました(図9.)。一方でP2の濃度割合が増加していることから、P1の粒子の中にはLNP表面にmRNAが付着していた粒子が存在し、RNase処理によってこの粒子が失われたことが示唆されます(図9.右図)。
また、細胞不透過性の核酸色素で標識した後に検出される蛍光シグナルは、LNP表面に結合したmRNAとFree mRNAに由来します。そこで、SS-FLデュアルトリガーを使用し各集団の解析を行うと、(図10.)におけるP3はFree mRNA、P2はEmpty LNPであり、P1はmRNAがLNPの表面に吸着した粒子であると考えることができます(図10.左)。また、このサンプルに対してRNase処理を行うと、P1とP3の個体数は激減しています(図10.右)。
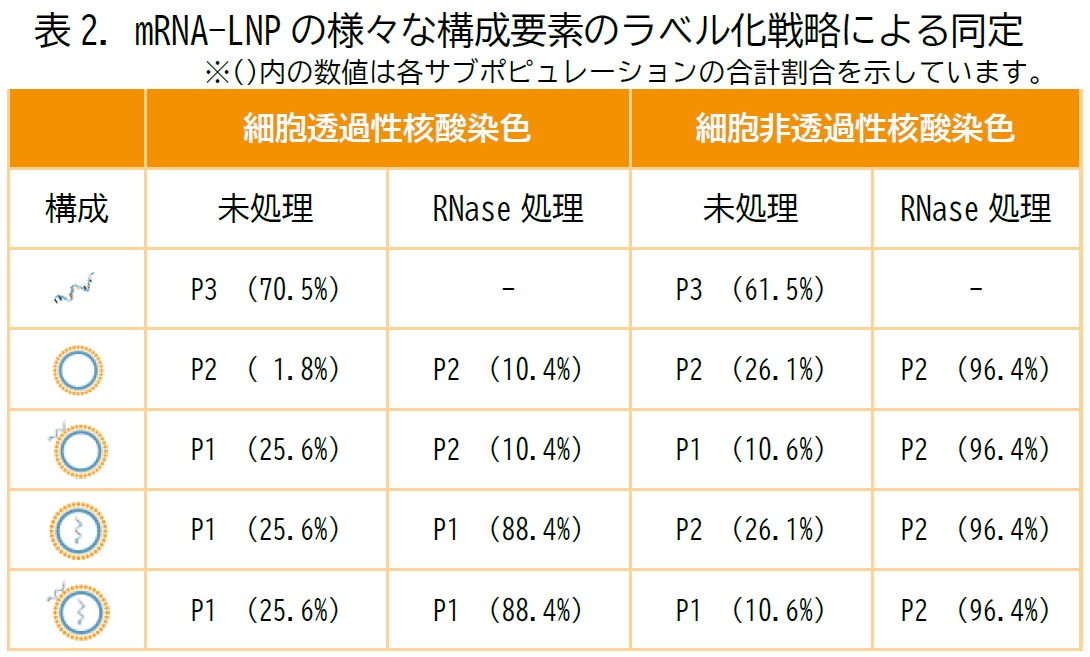
表2. はこれらの標識戦略によるmRNA局在アッセイの結果をまとめたものであり、より高品質なmRNA-LNPの製造のための分析に活用いただくことができます。
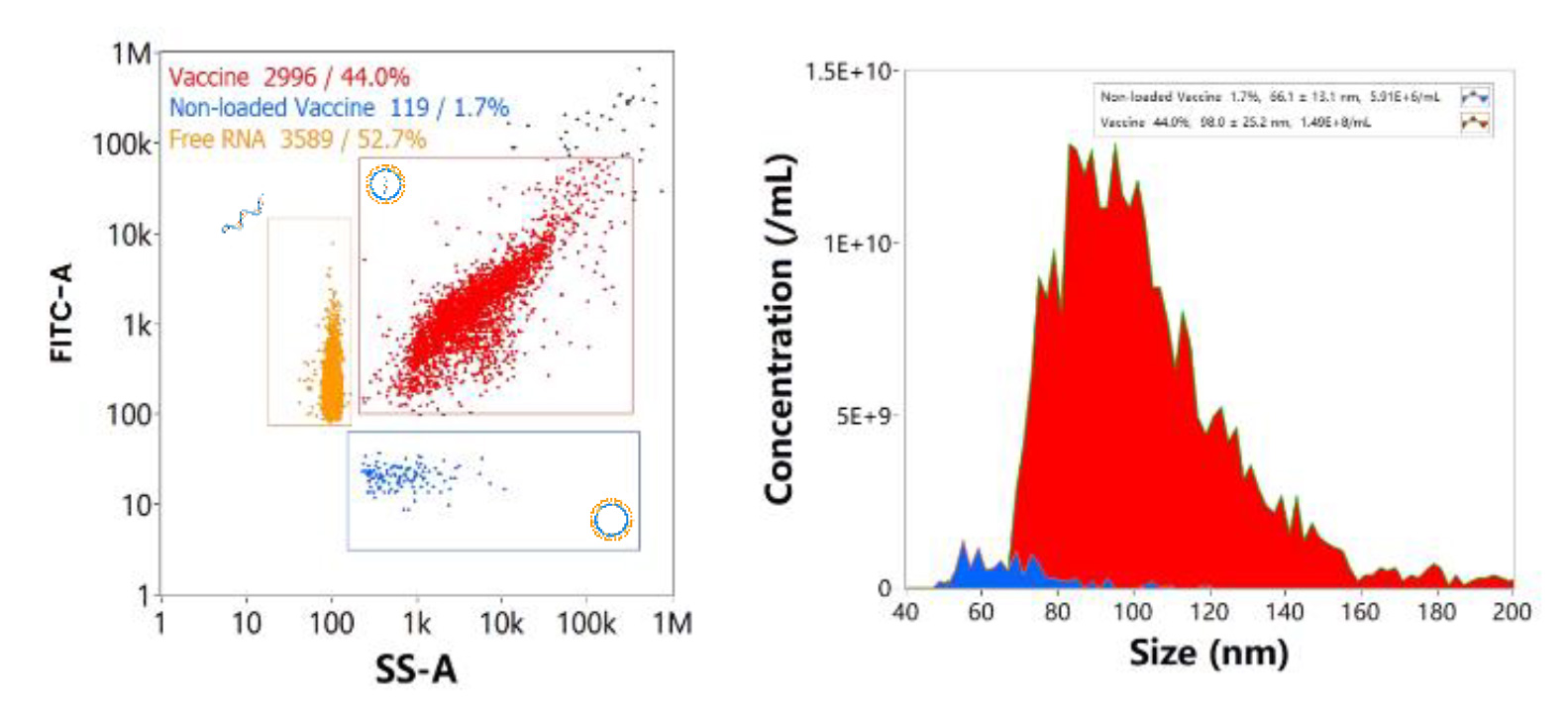
図8. mRNAワクチンにおける代表的な集団分布
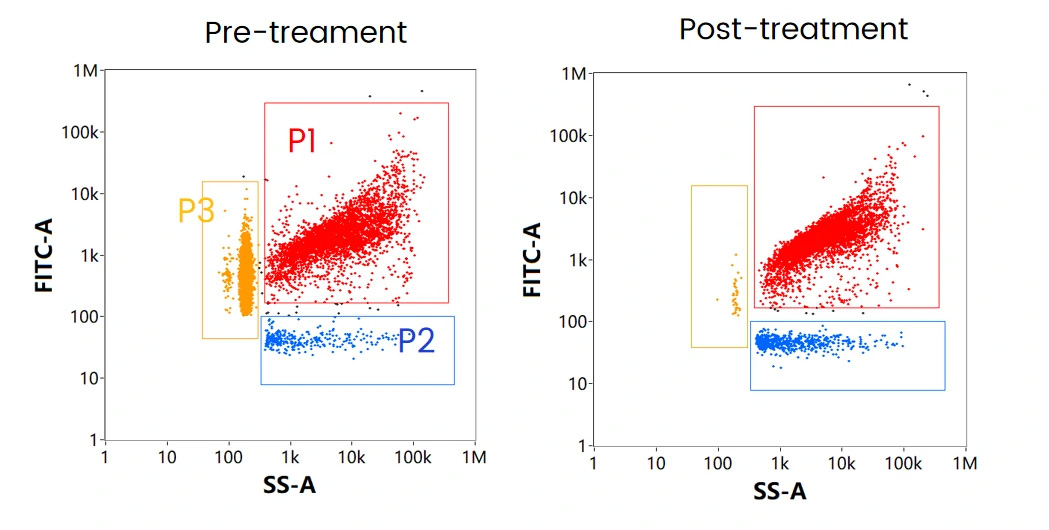

図9. 細胞透過性核酸染色によるmRNA-LNP解析
(左:未処理、右:RNase処理後)
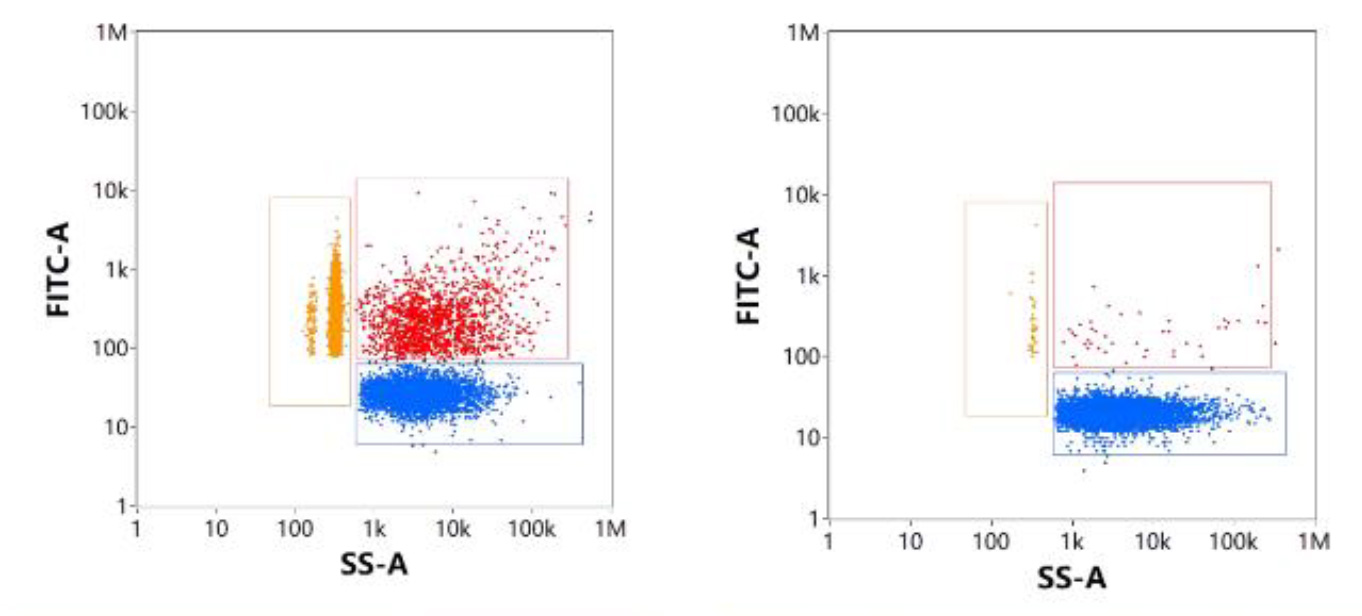

図10.細胞非透過性核酸染色によるmRNA-LNP解析
(左:未処理、右:RNase処理後)
表面リガンドの定量解析によるナノメディシンの高機能化
核酸医薬の治療効果をさらに高めるための戦略として、薬物送達を選択的に行うためのアクティブターゲティングが注目されています。表面リガンドには、タンパク質、ペプチド、アプタマー、低分子など様々な種類があります。標的ナノ粒子上のリガンドのキャラクタリゼーションは通常アンサンブル平均法で行われていますが、従来の方法では粒子間のばらつきに関する情報を得ることはできません。また、表面リガンドの密度は細胞内へのリポソームの取り込みに重要な役割を果たすため、1粒子単位で正確に定量化することは重要です。
そこで、葉酸修飾リポソームをモデル系として、NanoFCMを用いた表面リガンドの定量実証試験を行いました。リポソーム表面の修飾葉酸リガンドを認識するために、蛍光標識された組み換え葉酸レセプターを利用しました。NanoFCMの解析では、各リポソームについて側方散乱(SSC)と蛍光シグナルを同時に取得しました。SSC強度の校正には単分散SiNPを、FL強度の校正には等価可溶性蛍光色素(MESF)の単位で明るさが既知の蛍光SiNPを使用することで、サンプルの粒子径とリガンドの数を定量化しました(図11)。
解析の結果、葉酸のリガンド密度はリガンドを投入すると増加し続けることがわかり、リポソーム設計における柔軟性が浮き彫りになりました。しかし、細胞への取り込みに最適な密度は、100nm2 あたり0.5から2.0リガンドの間に収まりました。また、この数値はほとんどのウイルスのスパイク密度とよく一致しています。 この手法はトランスフェリンやHER2抗体など、他のターゲティングモチーフのリガンド密度測定にも用いることができ、薬物送達システムにおける調製プロトコルの最適化やバッチ間の品質管理などの前臨床開発に活用可能です。
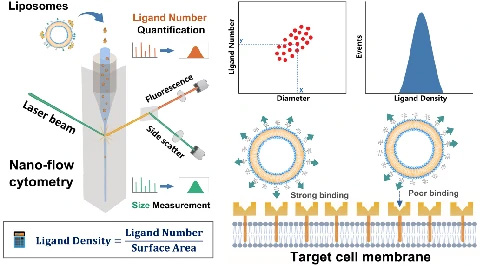
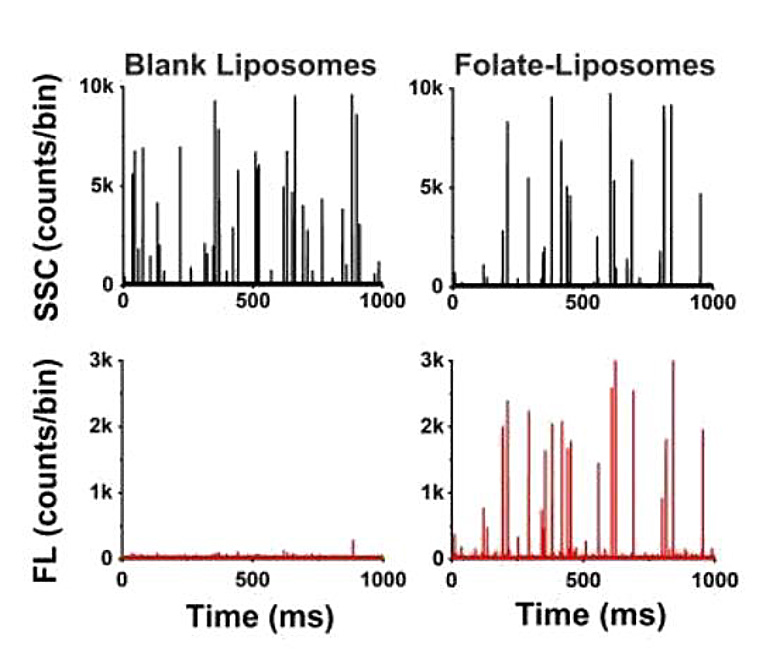
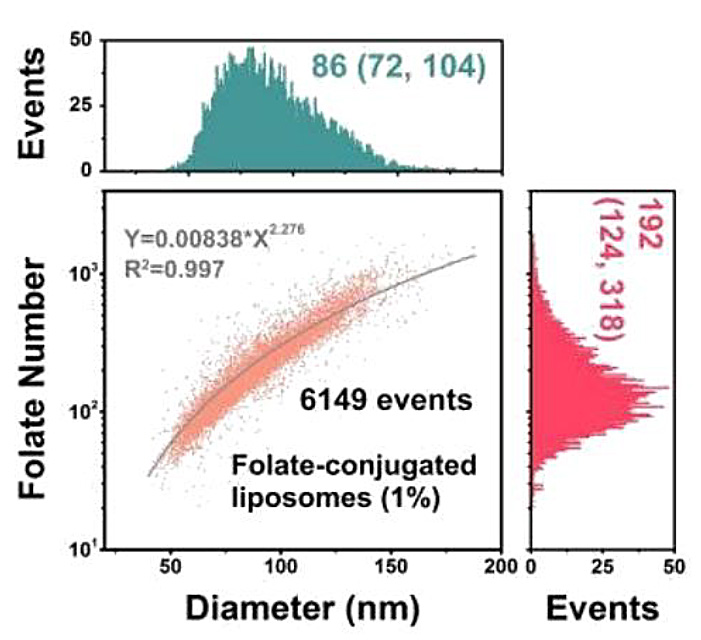
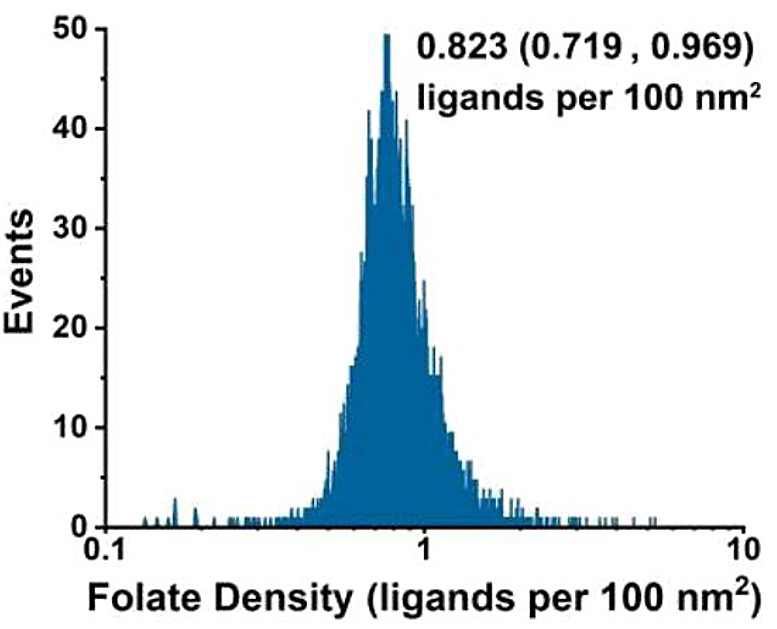
図11.リガンド結合リポソームの測定
(a)NanoFCMにおける測定イメージ (b)リガンド定量工程の模式図 (c)空のリポソームとリガンド結合リポソームのSSC,FLシグナル (d)リポソームにおけるFolate-Diameterドットプロット (e)リガンド密度の定量化
出展
- Liu M, Zhou T, Sheets R, et al. WHO informal consultation on regulatory considerations for evaluation of the quality, safety and efficacy of RNA-based prophylactic vaccines for infectious diseases, 20–22 April 2021[J]. Emerging microbes & infections, 2022 (just-accepted): 1-16.
- Hassett KJ, Higgins J, Woods A, et al. Impact of lipid nanoparticle size on mRNA vaccine immunogenicity[J]. Journal of Controlled Release, 2021, 335, 237-246.
- Zhu S, Ma L, Wang S, et al. Light-Scattering Detection below the Level of Single Fluorescent Molecules for High-Resolution Characterization of Functional Nanoparticles[J]. ACS Nano, 2014, 8(10):10998-11006.
- Chen C, Zhou Y, Chen C, et al. Quantification of Available Ligand Density on the Surface of Targeted Liposomal Nanomedicines at the Single-Particle Level[J]. ACS nano, 2022, 16(4):6886-6897.
- https://www.modernatx.com
- Evaluation of the quality, safety and efficacy of messanger RNA vaccines for the prevention of infectious diseases: regulatory considerations (POST-ECBS version). World Health Organization, October 2021.
その他のアプリケーション
ナノマテリアル ~ナノ粒子の総合測定スイート
近年、合成ナノ粒子は多くの分野で広く使用されており、特に生物医学、光学、エレクトロニクスなどで注目を集めています。これらのナノ粒子は高解像度イメージングや疾患診断、薬物ターゲティング、環境モニタリングなどに役立っています。しかし、ナノ粒子の応用には毒性の問題もあり、その安全性は粒径、形状、化学組成などに関連しています。
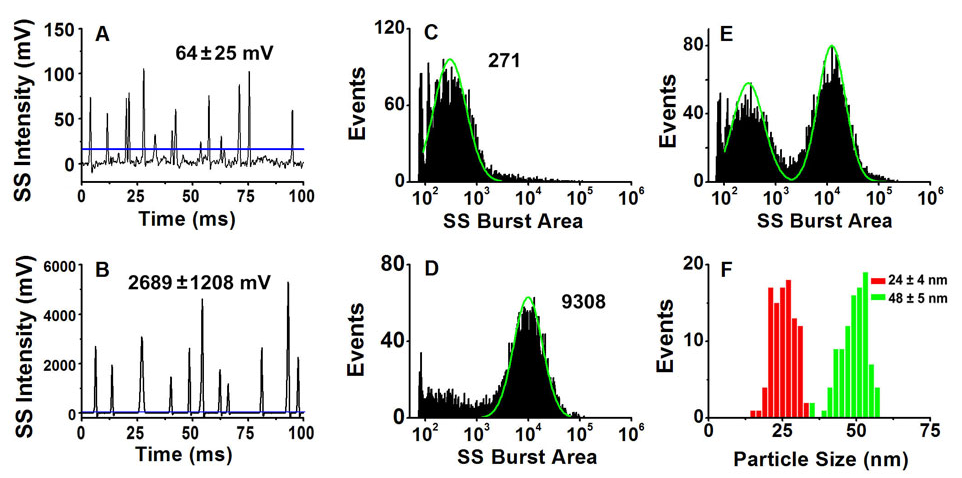
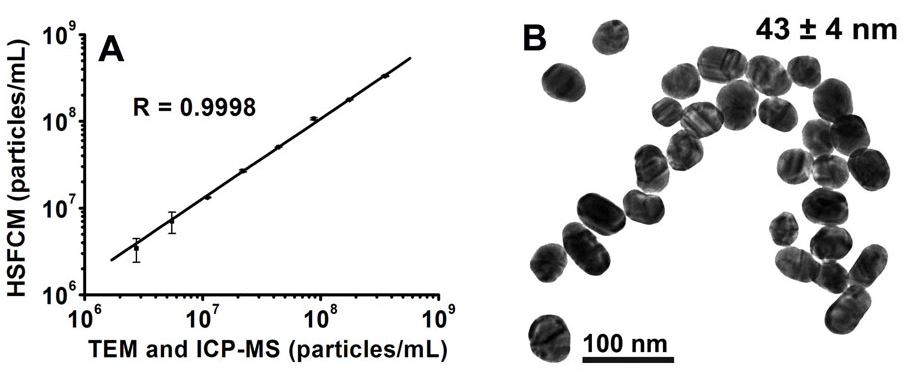
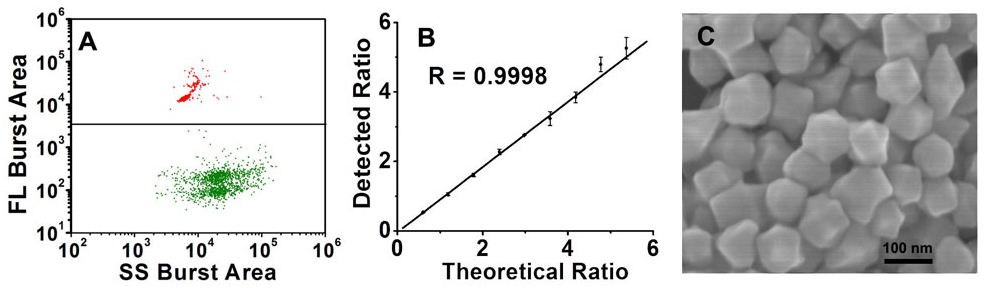
金ナノ粒子のサイズ微分と絶対定量
金ナノ粒子は特に医療や生物学的分析で注目を集めており、粒子サイズと濃度の正確な分析が重要です。TEMとDLSは一般的に使用される方法ですが、濃度の正確な測定手段が不足しています。金ナノ粒子の濃度は通常、TEMとICP-MSまたはICP-AESを組み合わせて分析されますが、この方法は複雑で時間がかかり、粒子の形状とサイズの不均一性により正確さに欠けることがあります。したがって、単一粒子数と試料の体積流量を用いた標準試料を用いない粒子濃度の絶対定量分析法が開発されました。また、蛍光内部標準を利用した簡単な定量法も開発されました。