アプリケーション

NEW
細胞外小胞の調製を安定化させる保存条件の特定
~V-Safe(EV保存用バッファー)による、EV安定性向上~
細胞外小胞 (EV) は生理的および病理的プロセスにおいて重要であり、治療および診断への大きな可能性を秘めていますが、研究においてEVの保存安定性の問題が課題とされています。
本研究では、保存バッファーによるEV安定性の影響を異なる条件で比較し、PBS中でのEVの保存が短期間でも回収率を大幅に減少させることを示しました。しかし、ヒト血清アルブミンとトレハロースを含むPBS (PBS-HAT = V-Safe) を使用することで、4℃冷蔵や、-80°C冷凍の条件下での長期保存や凍結融解サイクルにおいても安定した回収率を示しました。
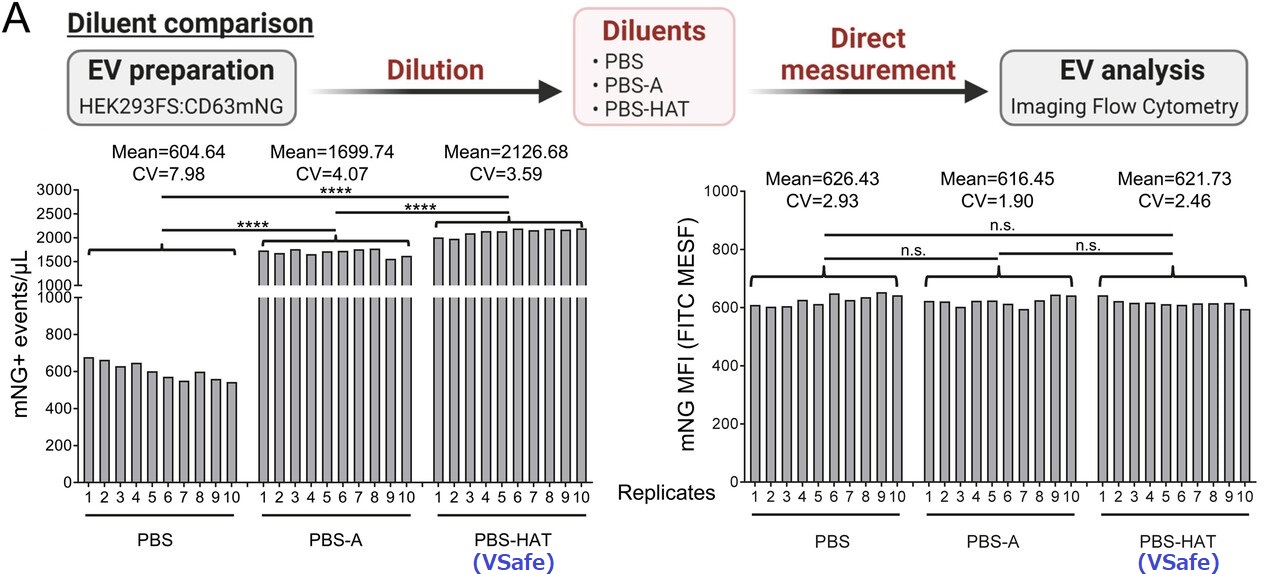
VRef-63mNG(リファレンスEV)を組成を変えた3種類のバッファー[PBS,PBS-A,V-Safe]で各20万倍希釈し、4℃条件下で、各サンプルのmNG蛍光ポジティブ率をImaging Flow Cytometry(IFCM)によって定量化しました。
左図:PBSで希釈したサンプルは、V-Safe と比較してmNG+ EVが3.5倍少ないことを示しました。PBSで希釈したEVの濃度は、10回の繰り返し測定でさらに低下していましたが、V-Safe で希釈したEVの測定は安定していました。
右図:mNG + EVの蛍光強度は経時的に変化していないことから、EVは凝集または破壊されず、PBSで保存された場合にプラスチックへの吸着が大きく影響していたことを示しています。
上記より、V-Safe のようなより適切なバッファーを、保存目的だけでなく、あらゆるダウンストリームEVアッセイの希釈ステップに使用することの重要性を強調しています。
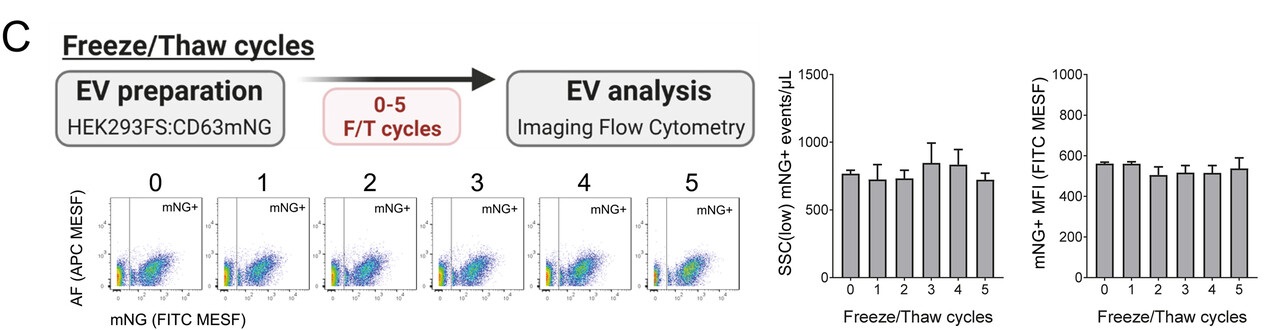
凍結融解サイクルによる安定性への影響をV-Safe で保存されたEVで確認しました。
-80℃保管で最大5回の凍結融解サイクル後のmNG+EV のIFCM 分析を実施しました。
ヒト血清アルブミンとトレハロースを添加したV-Safe が、-80°Cでの保管時において、サンプルの希釈および短期・長期保存に最も適した条件であることが明らかになりました。
さらに、複数回の凍結融解サイクルを経ても安定性を維持することが確認され、サンプルの品質を長期間保つ、優れたバッファーであることが示されました。
V-Safe は、タンパク質やナノ粒子の変性を防ぎ、再現性と信頼性を向上させることから、研究・製造現場において最適な選択肢となります。
参考文献:
André Görgens, Giulia Corso, Daniel W. Hagey, Rim Jawad Wiklander, Manuela O. Gustafsson, Ulrika Felldin, Yi Lee, R. Beklem Bostancioglu, Helena Sork, Xiuming Liang.
Identification of storage conditions stabilizing extracellular vesicles preparations.
Journal of Extracellular Vesicles.
June 2022, 11(6), https://doi.org/10.1002/jev2.12238
未結合の色素と抗体の除去①
VSEC-35(遠心分離SECカラム) アプリケーション
英国バーミンガムのアストン大学アンドリュー・デビット教授の研究室では、アポトーシス細胞由来細胞外小胞 (ACdEV) の放出による細胞死と免疫系へのシグナル伝達を研究しています。特に、ACdEV が自然免疫細胞を調節する分子メカニズムに興味を持っており、マクロファージの炎症状態に対する ACdEV 表面プロテオームの寄与に焦点を当てています。
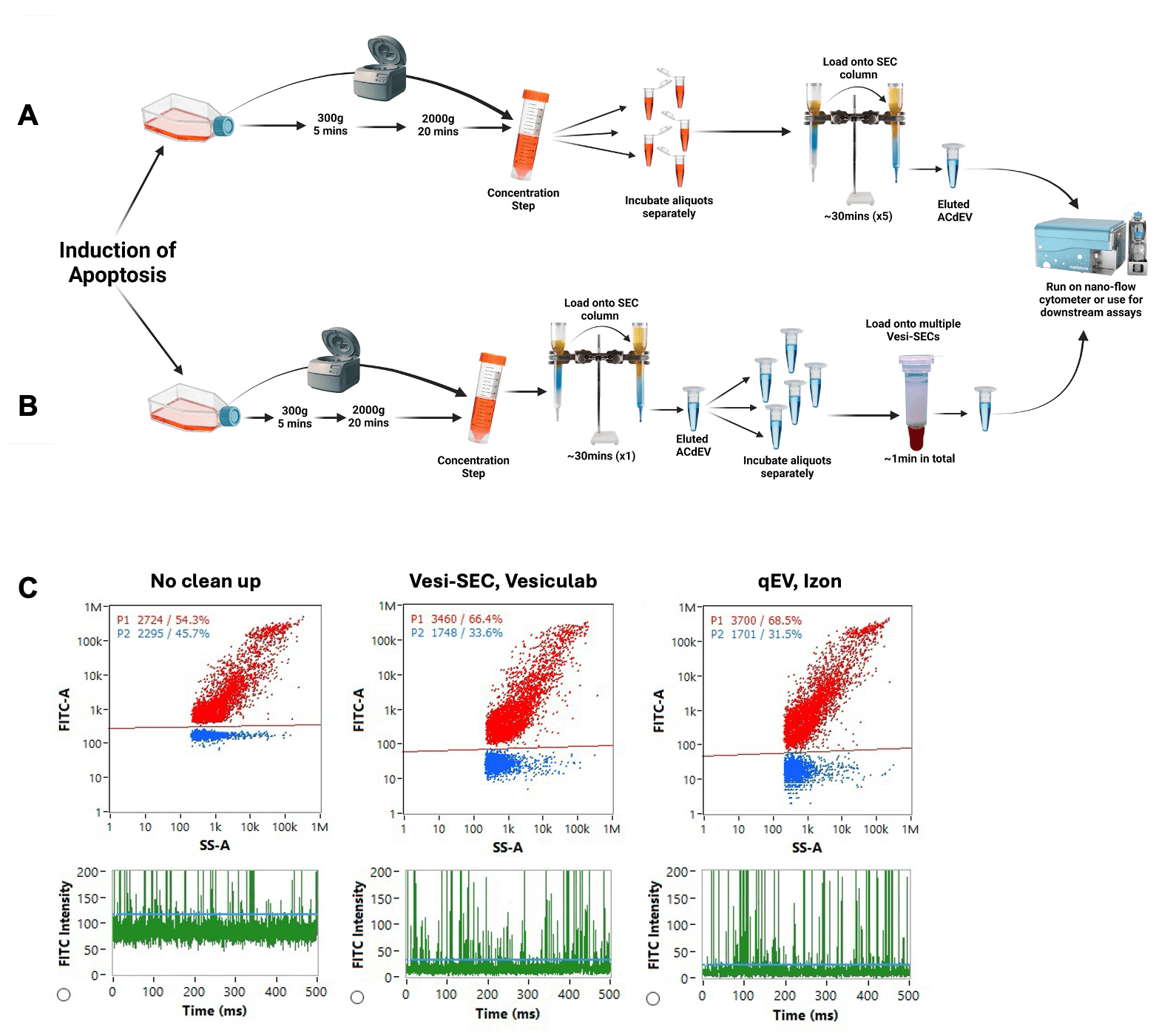
BODIPY™ FL マレイミド標識 ACdEV のバックグラウンドノイズの低減において、
qEV original と同等の効率を示しています。
A) qEVの分離システム SEC(EVのサイズ排除クロマトグラフィー)を繰り返して同時に ACdEV を分離し、染料/抗体をクリーンアップすると時間がかかり、大量のサンプルが必要になります。
B) qEVの分離システム SEC (EVのサイズ排除クロマトグラフィー)による ACdEV 分離に続いて、 VSEC-35(遠心分離SECカラム) による未結合色素/抗体のクリーンアップにより、ワークフローの効率が向上します。
C) 代表的なフロープロットと FITC イベントバーストトレース。
過剰な BODIPY™ FL マレイミド色素によって引き起こされる FITC チャネルのバックグラウンド ノイズが約 4 倍減少したことからもわかるように、VSEC-35(遠心分離SECカラム) は過剰な未結合蛍光体を除去する点で qEV original と同等の効率性があることがわかります。
濃度が希釈される qEV original とは異なり、サンプルの濃度と容量を維持します (表1)。さらに、VSEC-35(遠心分離SECカラム) 1 個あたりの必要なサンプル容量は最小限 (50 ~ 100 μL) であるため、必要な色素/抗体の量を減らすことができます。
VSEC-35(遠心分離SECカラム)を染料/抗体インキュベーションワークフローに組み込むことで、ACdEV の短時間・高スループット処理が可能になり、各 ACdEV サンプルから得られる情報が最大化されます。
| サンプルの準備 | ACdEVの濃度 (BODIPY™+粒子/mL) | クリーンアップ手順前の ボリューム | クリーンアップ手順後に 収集されたボリューム |
|---|---|---|---|
| クリーンアップなし | 1.94E+10 | 該当なし | 該当なし |
| VSEC-35 (遠心分離SECカラム) | 2.46E+10 | 100μL | 100μL |
| qEV original | 6.58E+9 | 500μL | 100μL |
VSEC-35(遠心分離SECカラム)と qEV originalによるサンプルのクリーンアップにより、
以前は隠れていた集団が明らかになり、
BODIPY™+ 粒子/mL の濃度がより高くなったと報告されています。
濃度はフローナノアナライザー (NanoFCM) で測定しました (N = 1)。
未結合の色素と抗体の除去②
VSEC-35(遠心分離SECカラム) アプリケーション
蛍光標識 CD63 抗体を EV の特異的タグ付けに使用することの有効性を示しています。VSEC-35(遠心分離SECカラム) カラムを使用することで、余分な抗体と親油性色素で染色された EV を効率的に除去でき、その後のナノフローサイトメトリー分析の明瞭性と信頼性が大幅に向上します (図 1 、 2)。
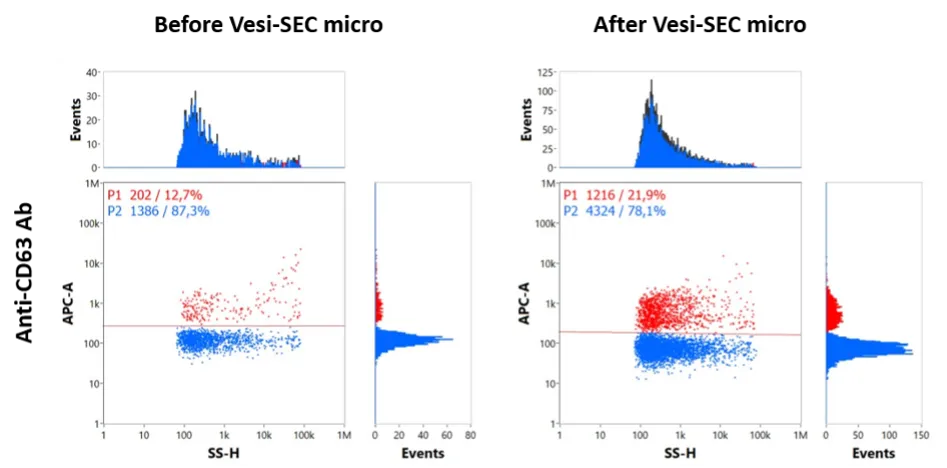
分画遠心分離と接線流濾過の組み合わせを使用して腹水から EV を分離し、続いて Sepharose CL-2B 10mL カラムでサイズ排除クロマトグラフィーを行いました。
約 5 × 10 8個の粒子を APC 標識 CD63 抗体 (クローン H5C6、Biolegend) とともに、4 °C で一晩、一定速度で撹拌しながらインキュベートしました。EV は VSEC-35(遠心分離SECカラム)で処理する前 (pre) と処理した後 (post) の両方でナノフローサイトメトリーで分析しました。二変量ドットプロットは、蛍光強度 (APC) と側方散乱 (SSC) の関係を示しており、処理後のシグナル増幅を強調しています。
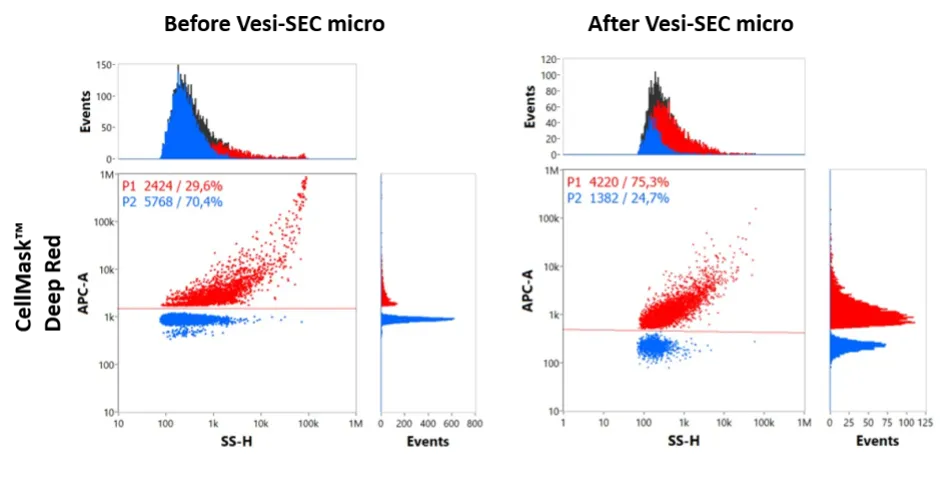
分画遠心分離とタンジェンシャルフロー濾過の組み合わせを使用して腹水から EV を分離し、続いて Sepharose CL-2B 10mL カラムでサイズ排除クロマトグラフィーを行いました。約 5 × 10 8個の粒子を蛍光標識親油性色素クローン (CellMask™ Deep Red、Thermo Fisher Scientific) とともに室温で 1 時間インキュベートしました。EV は、VSEC-35(遠心分離SECカラム)で処理する前 (pre) と処理した後 (post) の両方でナノフローサイトメトリーで分析しました。二変量ドットプロットは、蛍光強度 (APC) と側方散乱 (SSC) の関係を示しており、処理後のシグナル増幅を強調しています。

