アプリケーション
TissueSTART(ティッシュスタート)
ミクストルーサー式バイオ3Dプリンター

■ 組織培養の未来を切り拓く 最新のアプリケーション公開中
FRESH法によるバイオプリンティング
3Dバイオプリント技術は、複雑な構造を得るために軟質材料をプリントする際に達成される解像度に制限されることがあります(1)。Freeform Reversible Embedding of Suspended Hydrogels (FRESH) 法は、コラーゲンなどの軟質バイオ材料を正確に成膜できるよう開発されました(2)。
FRESH法では、熱可逆性で粘性のあるゼラチンスラリーからなる支持床が、印刷ノズルを柔軟に支持します。ノズルは抵抗なく容易にサポートベッドを貫通し、印刷されたハイドロゲル構造体を崩壊しないように保持することができる。37℃まで温度を上げると、ゼラチンが液体となりゲルではなくなるので、支持体ハイドロゲルは印刷された構造体から離脱する。3Dプリント後、ゼラチンスラリーを除去すると、高い細胞生存率が観察され、FRESH 3Dバイオプリンティングが細胞に優しいプロセスであることがわかります。

図1.FRESH法(freeform reversible embedding of suspended hydrogels)による複雑な生体構造の3次元印刷。(2)
Leeら(2019)は、コラーゲンを3DバイオプリントするFRESH法を用いて、毛細血管から臓器全体まで、さまざまなスケールでヒト心臓のコンポーネントを設計しました。最初に注目したのは、小さな冠動脈の簡略化されたモデル、つまりパーソナライズされた脈動灌流システムによる灌流のためのI型コラーゲンスケール上の線状チューブのプリントでした。その後、研究者たちは、ヒトの心筋細胞をプリントした心室が、同期した収縮を示すことを発見しました。さらに、FRESH 3Dバイオプリント心臓は、マイクロトモグラフィーから得られた患者固有の解剖学的構造を正確に再現しています。(1)
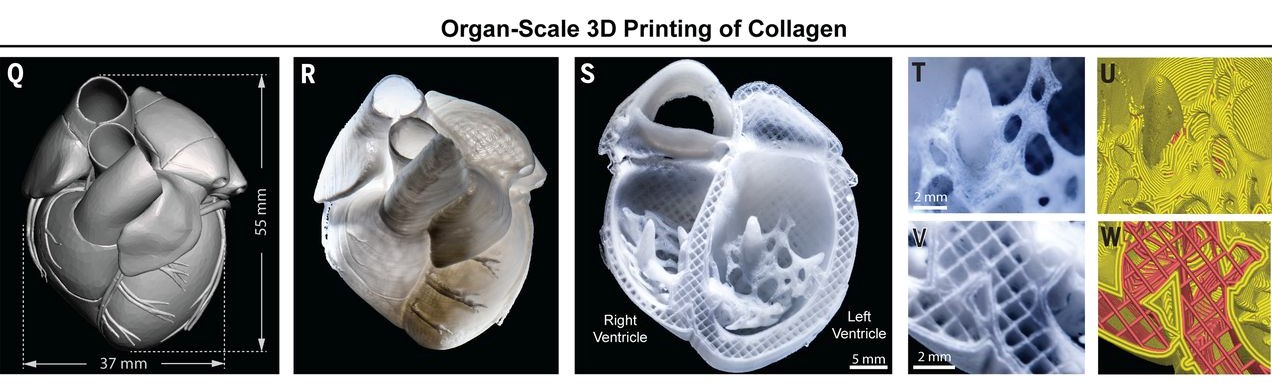
図2.FRESH法を用いたコラーゲンの3Dバイオプリンティングで、ヒトの心臓の構成要素を再構築する。
Bordoniら(2020)は、FRESH法を用いて、脳スライスに似た構築物を高解像度で3Dプリントした。研究チームは、導電性足場のバイオプリントのために、セルロースナノフィブリル、アルギン酸、単層カーボンナノチューブに基づくバイオインクを用意し、ヒト神経芽腫細胞(SH-SY5Y細胞株)の分化を観察しました。その結果、分化因子の使用に関わらず、導電性材料が細胞の分化を促進することが実証されました。本研究により、in vitroでリアルな3D神経モデルを作成し、神経変性疾患の病態メカニズムの理解を深めることができる道が開かれました。(5)
参考文献 ※( )内の数字
- (1) Lee, A. et al. 3D bioprinting of collagen to rebuild components of the human heart. Science 365, 482–487 (2019).
- (2) Hinton, T. J. et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Sci Adv 1, e1500758 (2015).
- (3) Dasgupta, Q. & Black, L. D., 3rd. A FRESH SLATE for 3D bioprinting. Science vol. 365 446–447 (2019).
- (4) Jeon, O., Bin Lee, Y., Hinton, T. J., Feinberg, A. W. & Alsberg, E. Cryopreserved cell-laden alginate microgel bioink for 3D bioprinting of living tissues. Mater Today Chem 12, 61–70 (2019).
- (5) Bordoni, M. et al. 3D Printed Conductive Nanocellulose Scaffolds for the Differentiation of Human Neuroblastoma Cells. Cells 9, (2020).
細菌感染症を理解するための3D皮膚モデル構築
手術後の患者において細菌感染による合併症は四肢の切断にもつながるため、創傷感染と外傷の迅速な診断と治療が重要となります。(1),(2) しかし、皮膚感染症の研究は経済的・倫理的な制約により制限され、通常は単層細胞培養(または2D)モデルが使用されます。このような細胞培養は、生体内の細胞環境を反映しておらず、細胞間の相互作用や遺伝子やタンパク質の発現が制限されています。そのため、2D培養モデルを3D培養モデルに置き換えることで、より現実的に皮膚感染を再現することができます。さらに、3D培養モデルには組織構造や宿主環境に存在する細胞タイプを維持するなどの利点もあり、これは非常に興味深いことです。(2)
3D皮膚は人間の表皮の形態的・分子的特徴を反映することができるため、皮膚科学研究のプラットフォームとして利用されています。また、皮膚微生物叢の観点からヒトの自然免疫に関する知識が飛躍的に発展してきました。この微生物叢の組成の変化は、炎症性皮膚疾患の悪化などの影響を与える可能性があります。(3)

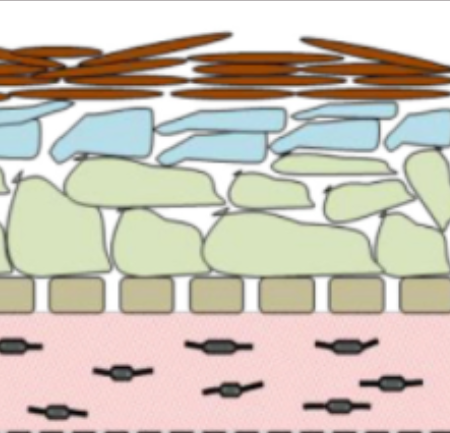
図1:3次元皮膚モデルの模式図
3D皮膚モデルに関する研究の増加は、皮膚科学および皮膚化粧品研究においてモデルとして使用される動物の数を減らすことにも貢献する可能性があります。(3) 有機型3D皮膚モデルは通常、初代または不死化ヒトケラチノサイトで構成され、線維芽細胞を播種することもできます。Popovら(2014)は、黄色ブドウ球菌の皮膚コロニー形成と感染プロセスを調べるために、3Dオーガノタイピングヒト皮膚組織モデルを開発しました。黄色ブドウ球菌の感染症は様々な臨床症状で現れますが、その大半は皮膚感染症です。 このような皮膚モデルを用いることで、黄色ブドウ球菌に対する免疫が表皮上の細菌集団の挙動や侵襲性感染症に対する防御にどのような影響を与えるかを評価することができます。(4)
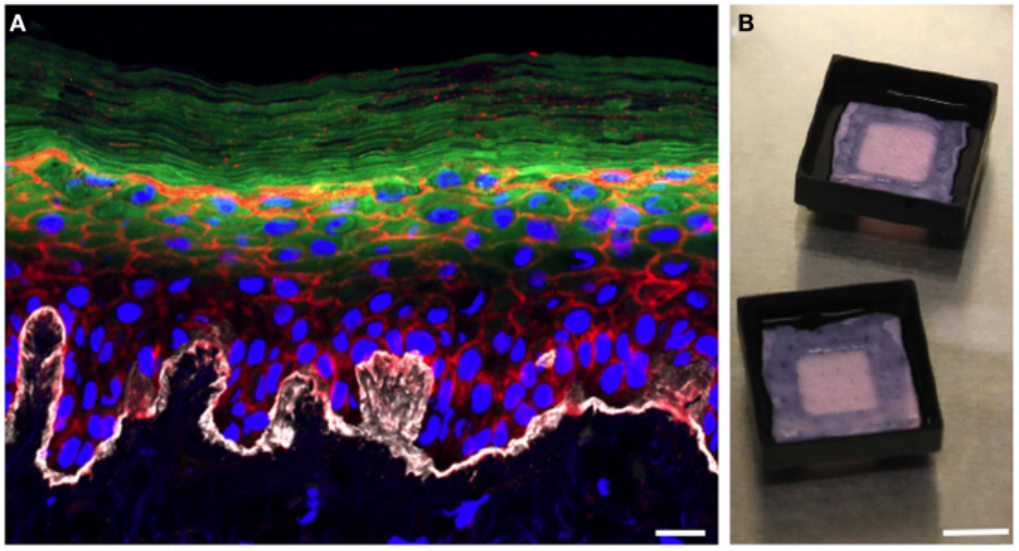
図2:3Dオーガノタイピングヒト表皮組織モデルは、表皮の層状構造を再現している。(4)
また、ドイツのイエナ大学病院では、防腐剤の生理活性と生体適合性を評価するために、皮膚の3Dモデルを開発しました(適用濃度:1,000mg)。皮膚モデルは、真皮としてコラーゲンに埋め込まれた線維芽細胞と、ケラチノサイトで構築された表皮で構成されています。感染した皮膚モデルを、ポリヘキサニド、オクテニジン二塩酸塩、クロルヘキシジングルコン酸塩、ポビドンヨードという防腐剤で24時間処理し、黄色ブドウ球菌による感染から構造を保護しています。この研究の結果は、提案したモデルが新しい抗菌戦略の有効性を評価するための有望なツールであることを示しています。(5)
参考文献 ※( )内の数字
- (1) Havlikova, J., May, R. C., Styles, I. B. & Cooper, H. J. Direct identification of bacterial and human proteins from infected wounds in living 3D skin models. Sci. Rep. (2020).
- (2) Maboni, G. et al. A Novel 3D Skin Explant Model to Study Anaerobic Bacterial Infection. Front. Cell. Infect. Microbiol. 7, 404 (2017).
- (3) Rademacher, F., Simanski, M., Gläser, R. & Harder, J. Skin microbiota and human 3D skin models. Exp. Dermatol. 27, 489–494 (2018).
- (4) Popov, L., Kovalski, J., Grandi, G., Bagnoli, F. & Amieva, M. R. Three-Dimensional Human Skin Models to Understand Staphylococcus aureus Skin Colonization and Infection. Front. Immunol. 5, 41 (2014).
- (5) Reddersen, K., Wiegand, C., Elsner, P. & Hipler, U.-C. Three-dimensional human skin model infected with Staphylococcus aureus as a tool for evaluation of bioactivity and biocompatibility of antiseptics. Int. J. Antimicrob. Agents 54, 283–291 (2019).