SPARTAアプリケーション
ラマン分光法と自動レーザートラッピングの融合による革新的な解析
SPARTAは、高速かつ自動で粒子をとらえる独自のアルゴリズムを搭載しており、ほとんど前処理なしで、ボタンを押すだけでラマンスペクトルを取得できます。
SPARTAの基本原理は、Nature Communications誌にオープンアクセス論文として掲載されています。
Penders et al. ‘Single Particle Automated Raman Trapping Analysis.’ Nature Communications. 2018
こちらからお読みください
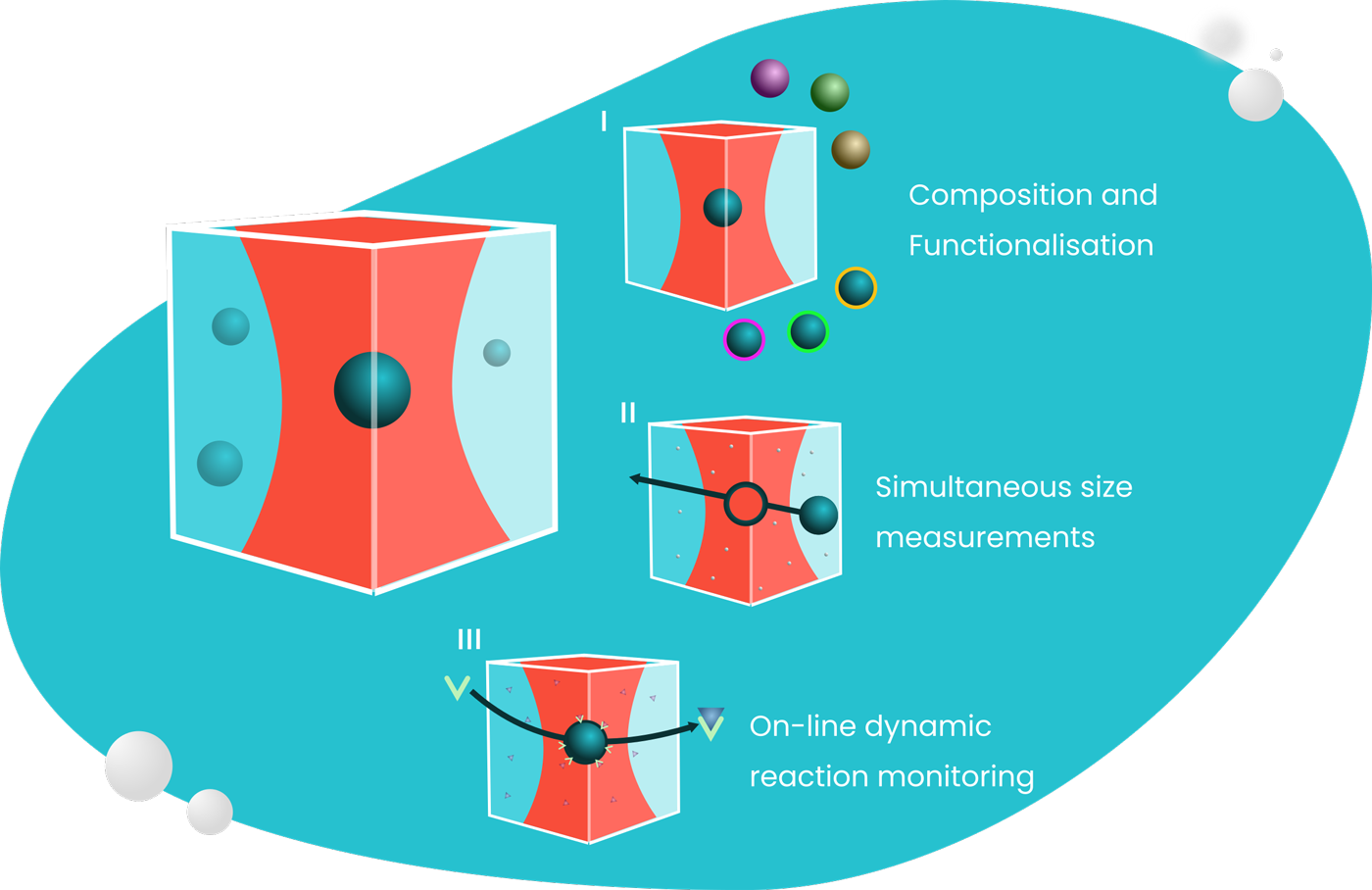
SPARTA の一般的な動作モードの例
単一粒子組成分析
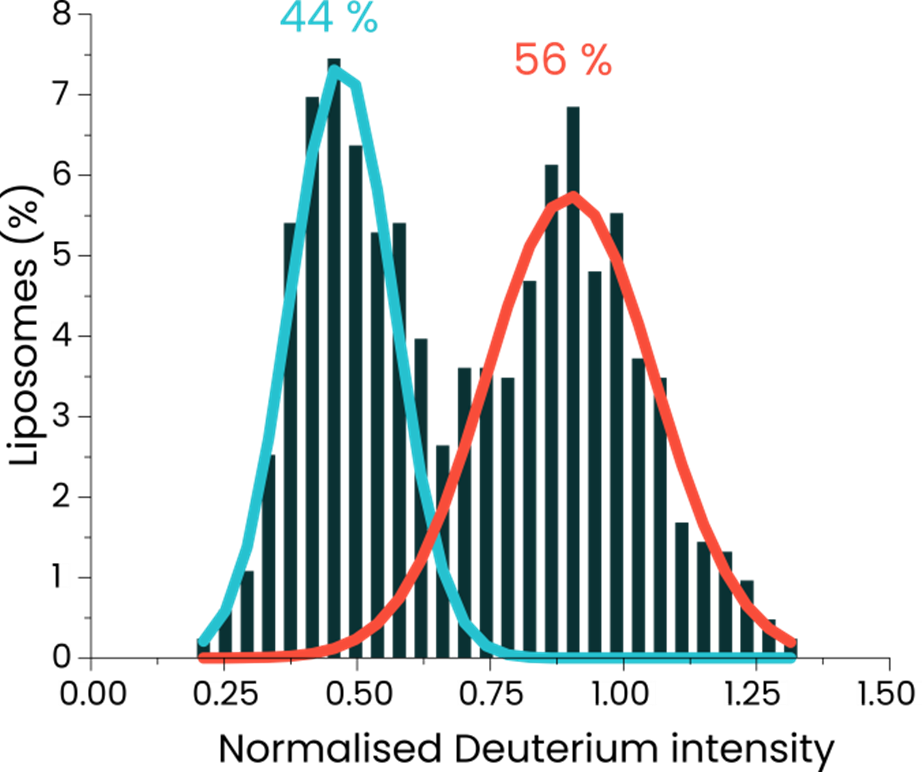
重水素化リポソームと非重水素化リポソームの50:50混合物をSPARTAで分析しました。
数百個の粒子をトラップし、特徴的な重水素ピークのスペクトルを解析。その結果、明確に2つのピークに分かれたヒストグラムが得られ、2種類のリポソームがはっきりと識別できることが示されました。
オンライン動的反応モニタリング
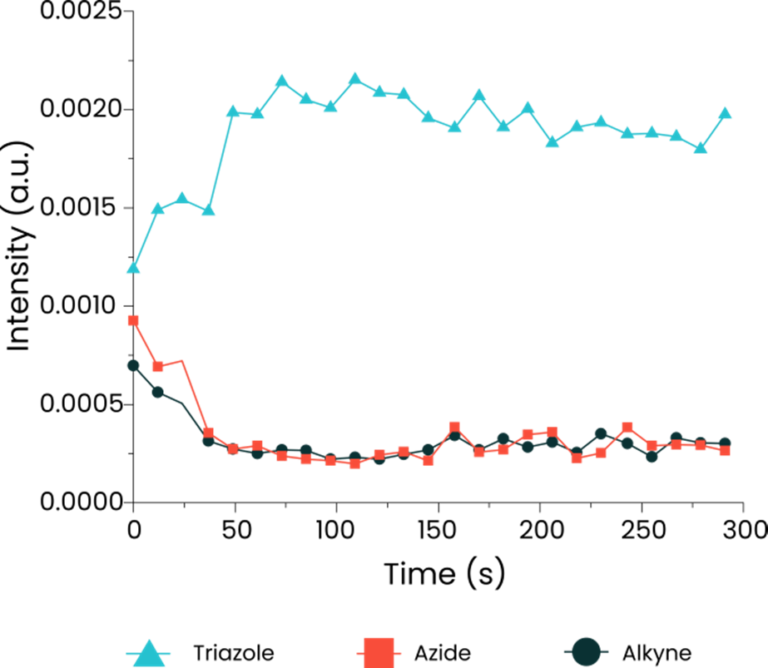
銅触媒アジド-アルキン環化付加(クリック)反応のモデル系をSPARTAで解析しました。
この反応は、単一粒子を1つずつ順番にトラップする方法や、1つの粒子を継続的にトラップしながら行う方法のいずれも対応可能です。
ラマンスペクトルの変化を追うことで、反応の進行をリアルタイムでモニタリングすることができました。


リポソーム製剤
一粒ごとに解析し、“粒子ごとの違い”を明らかに
薬物送達用ナノ医薬品を製剤化する際には、リポソーム内の低分子医薬品からLNP内の核酸に至るまで、ナノ粒子キャリアにどのような成分を担持させるかが重要な検討項目です。現在、キャリアへの担持量を評価する一般的な方法はバルク測定に依存しており、粒子を溶解し、HPLCなどの手法で成分を抽出・定量する必要があります。
SPARTAは、ナノ粒子1つひとつの負荷量を直接・非破壊で測定できる、従来にない測定手法を可能にします。
サンプルの改変は不要で、担持成分をそのまま特定・定量化できるため、開発プロセスが大幅に効率化されます。
さらに、粒子間のばらつき(不均一性)を明確に捉えることができ、従来法では見えなかった粒子レベルでの差異まで可視化することができます。
また、粒子サイズも同時に定性評価できるため、サイズと負荷量の関係を含めた「サイズ負荷特性」も評価できます。
これは、安全性・再現性に優れた製剤を実現し、予測可能な性能を確保するために欠かせない情報であり、研究開発から製造プロセスまでの最適化に直結します。
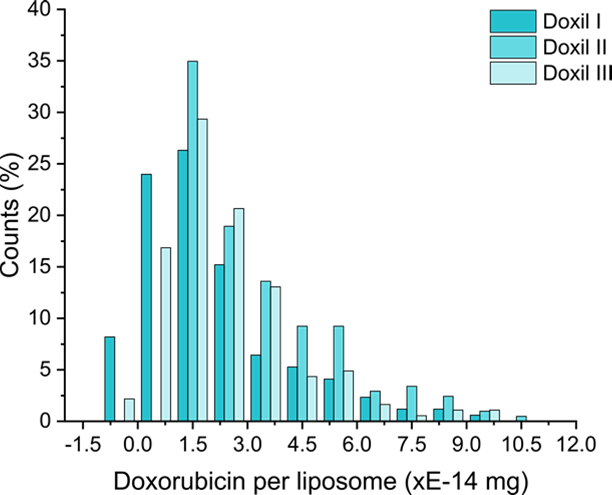
SPARTAを用いて、個々のリポソーム内に含まれるドキソルビシンの充填量を測定しました。
その結果、リポソーム1個あたりの平均充填量は 2.8 × 10⁻¹⁴ mg でしたが、粒子ごとでの明確なばらつきが確認され、中には、薬剤がほとんど含まれていない“空”に近いリポソームや、極端に多く充填されているリポソームも検出されました。
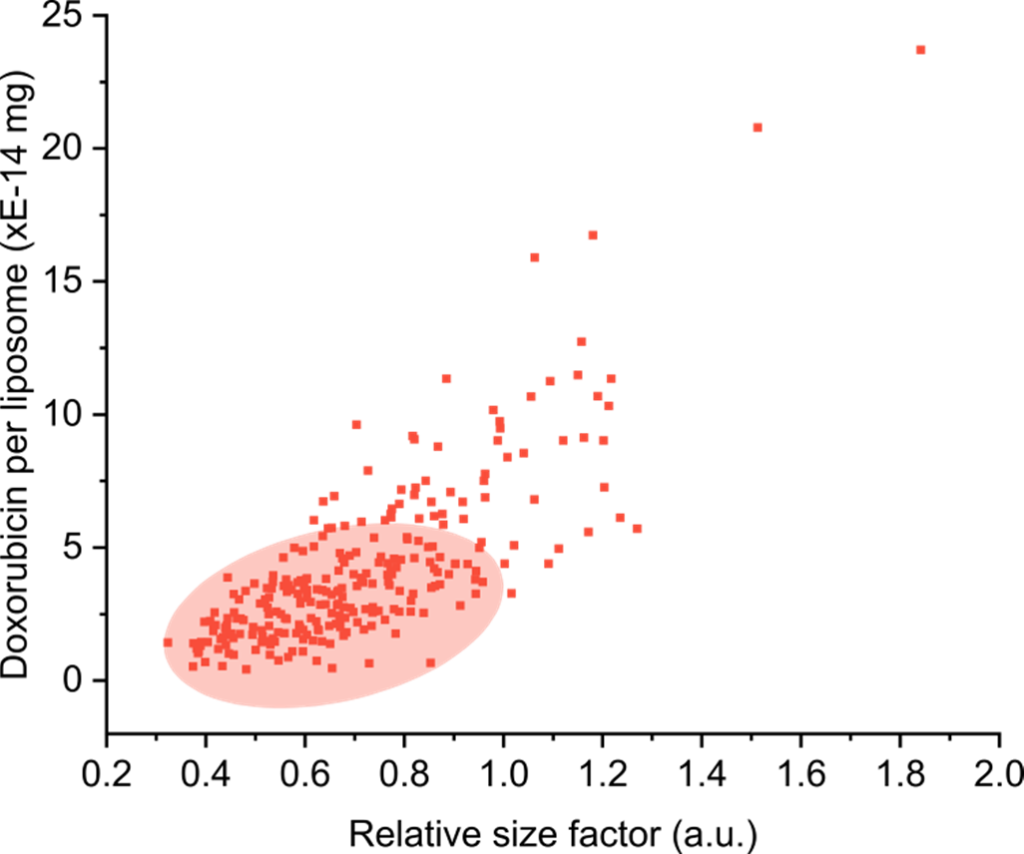
個々のリポソームのサイズ変化も同時に測定することで、粒子サイズと薬剤分布との関係を可視化できます。
リポソームの大半(約80%)は特定の範囲内に分布しており、この範囲では粒子サイズが大きくなっても、薬剤の負荷量に大きな変化は見られませんでした。
一方、粒子サイズの増加が著しく、それに伴って薬剤の充填量も極端に多くなるケースでは、有意な外れ値として検出されました。


ケーススタディ – LNP(脂質ナノ粒子)
LNPの成分構成や粒子ごとのばらつきを、ラベルフリーで解析
ナノ製剤に使用されるキャリアは、製剤の安定性を確保し、一貫した性能と保管を実現するために、複雑かつ綿密に設計された製品です。キャリアは通常、安定性を実現するために複数の成分で構成されており、細胞標的化のために表面機能化によってさらに強化されることもあります。SPARTA独自の分析機能は、キャリアの化学組成をラベルフリーで分析し、集団の異質性を評価することができるため、LNPなどの新しいキャリアの研究開発に最適です。SPARTAは、新しいリードキャリア製剤を迅速にスクリーニングし、効率的なスケールアップを促進するとともに、単一粒子レベルまで信頼性の高い製剤開発を可能にする製造プロセスを実現します。
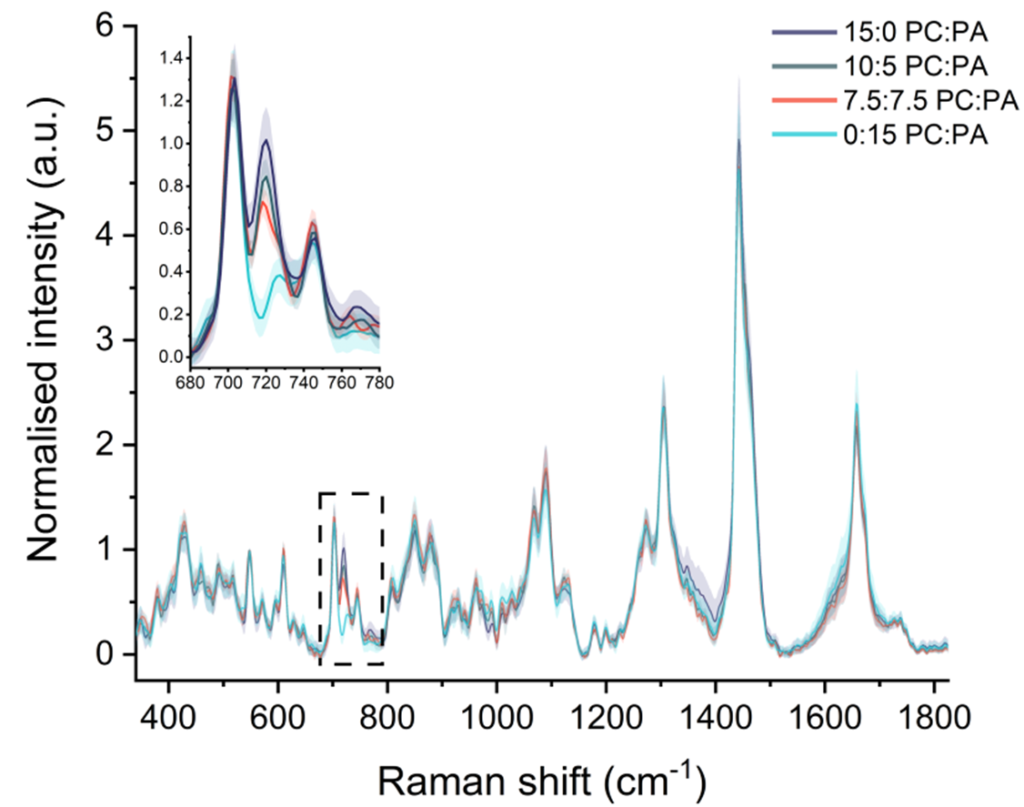
脂質組成の異なるLNPのラマンスペクトル
DOPC(PC)とDOPA(PA)のmol%が異なるLNPについて、SPARTAでの解析を行い、組成分析を行いました。DOPC:DOPA比の微細な変化を取得することができています。
脂質組成の異なるLNPごとのラマンスペクトルの変化
SPARTAの単一粒子スペクトルを使用して、LNP製剤の不均一性を決定しました。解析された平均傾向に加えて、各バッチ内の詳細な分布を確認することができるため、製剤生産プロセスを最適化するための重要な情報を取得することができます。
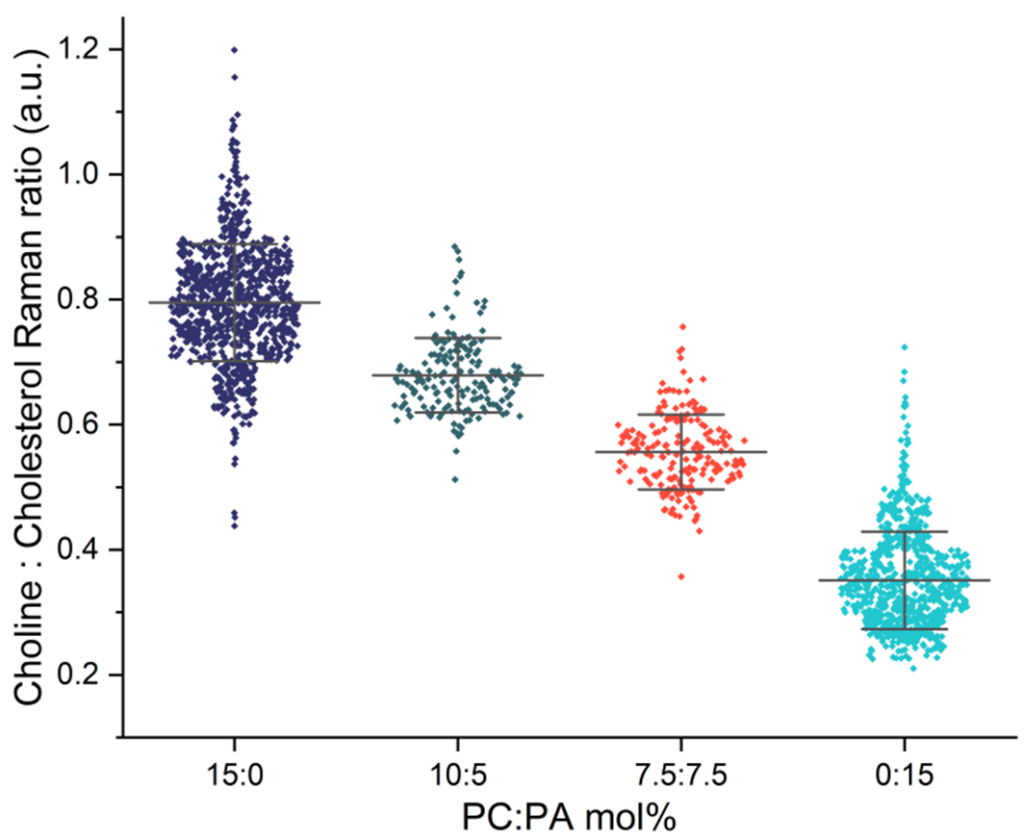
PA:Phosphatidic Acid
PC:Phosphatidylcholine
Barriga et al. ‘Coupling Lipid Nanoparticle Structure and Automated Single Particle Composition Analysis to Design Phospholipase Responsive Nanocarriers.’ Advanced Materials. 2022.
こちらをお読みください


ケーススタディ – 遺伝子治療ベクター
レンチウイルスベクターのSPARTA分析 – ベクターの性能のばらつきを克服
遺伝子治療は、個別化医療やナノ医療の分野で注目される最先端の治療法の一つです。
レンチウイルスなどのウイルスベクターは、核酸を目的の細胞に届けるために使用され、導入された遺伝子は宿主細胞のゲノムに組み込まれて、異常な遺伝子の修復を促します。
ウイルスは生きた細胞を使って製造されるため、安全かつ効果的な治療を確実に得るためには、精密な精製工程が欠かせません。また、ウイルスベクターの内容物が不完全に封入された場合、治療効果にばらつきが出るだけでなく、免疫反応のリスクも高まります。
こうした課題に対して、SPARTAは新しい遺伝子治療製剤の構造や品質を単一粒子レベルで可視化し、解決の糸口を提供します。ベクターの単粒子解析は、新製剤の開発の初期段階だけでなく、既存製剤の品質管理(QC)においても重要な課題解決に役立ちます。
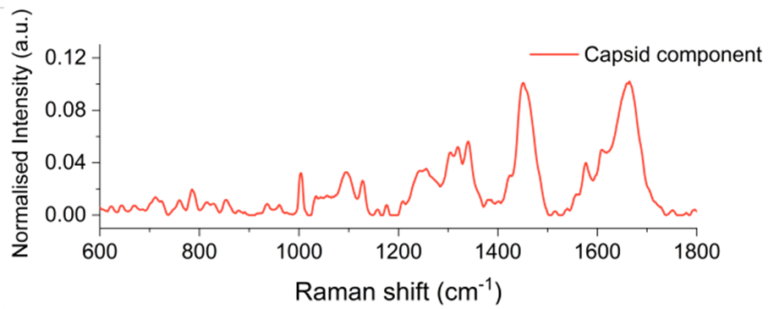
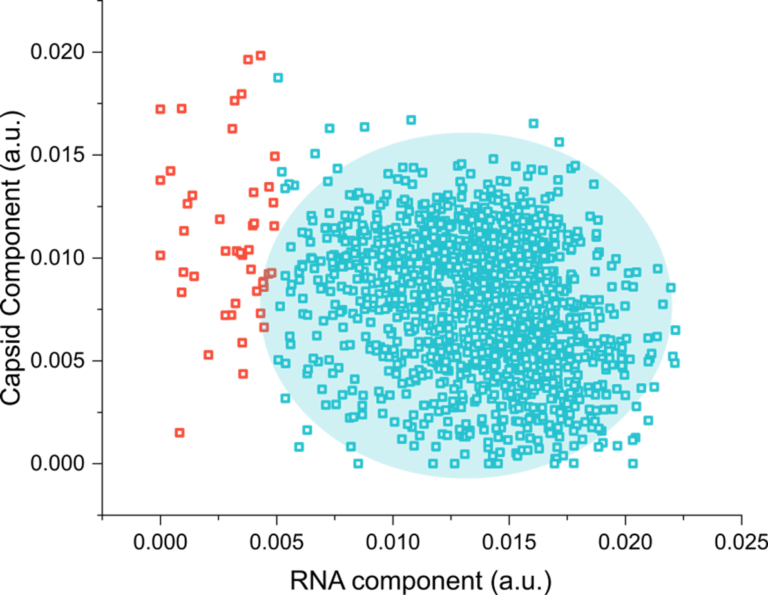
SPARTAを用いて1500粒子分のレンチウイルスベクターを解析し、得られた組成情報を用いてカプシドとRNAカーゴの相対含有量を抽出しました。その結果、ベクターの96.5%(青)が均一にローディングされていることが明らかになりましたが、3.5%(オレンジ)ではローディングが著しく低いことが示されました。
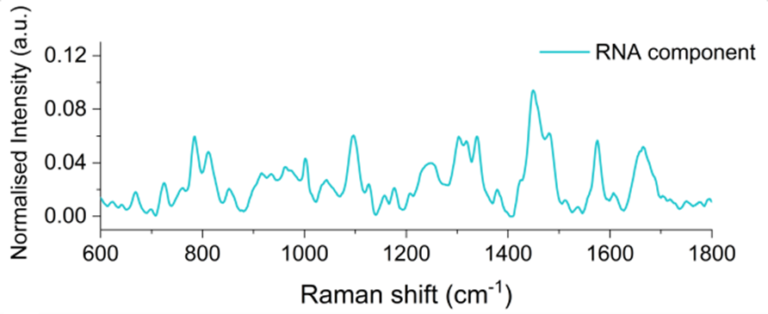


ケーススタディ – 細胞外小胞(EV)
がんバイオマーカーとしての細胞外小胞(EV)のSPARTA分析
細胞外小胞(EV)は、細胞由来ナノ粒子の一種であり、疾患診断のためのバイオマーカーから高度な薬物送達小胞まで、幅広い有望な用途が期待されています。SPARTAの強力な単粒子組成分析技術は、個々のEVの詳細なフィンガープリントを作成し、脂質、タンパク質、核酸の含有量を明らかにすることができます。これにより、異なる起源のEVをスクリーニングし、例えばがん由来のEVと非がん由来のEVを区別することが可能になります。
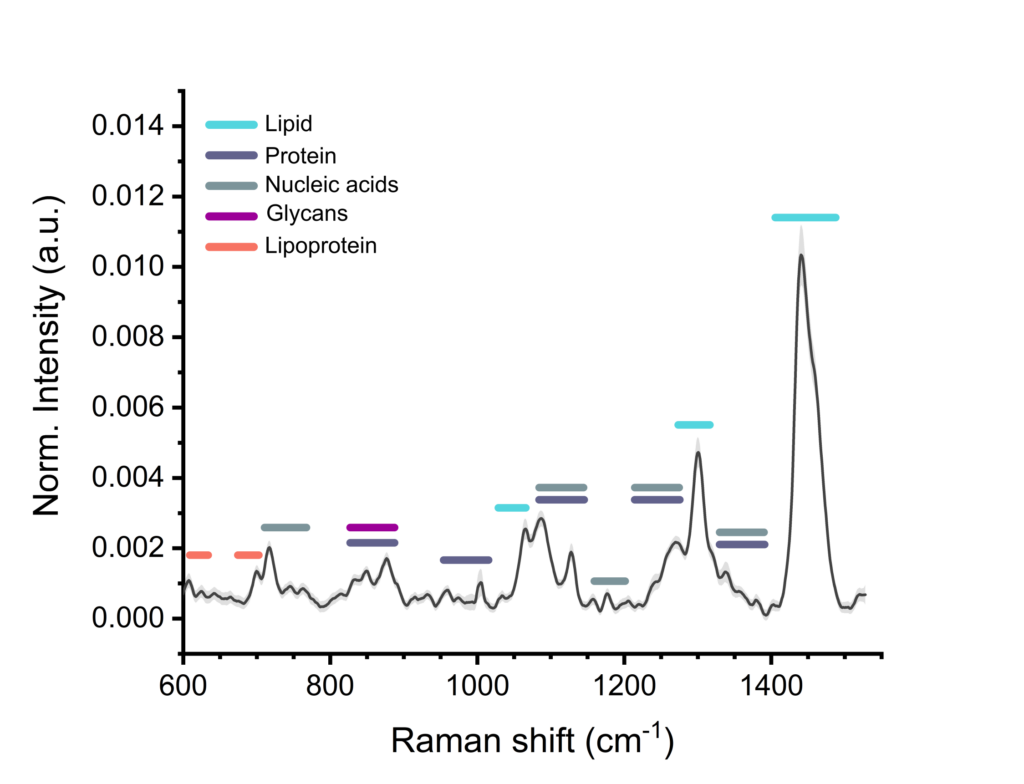
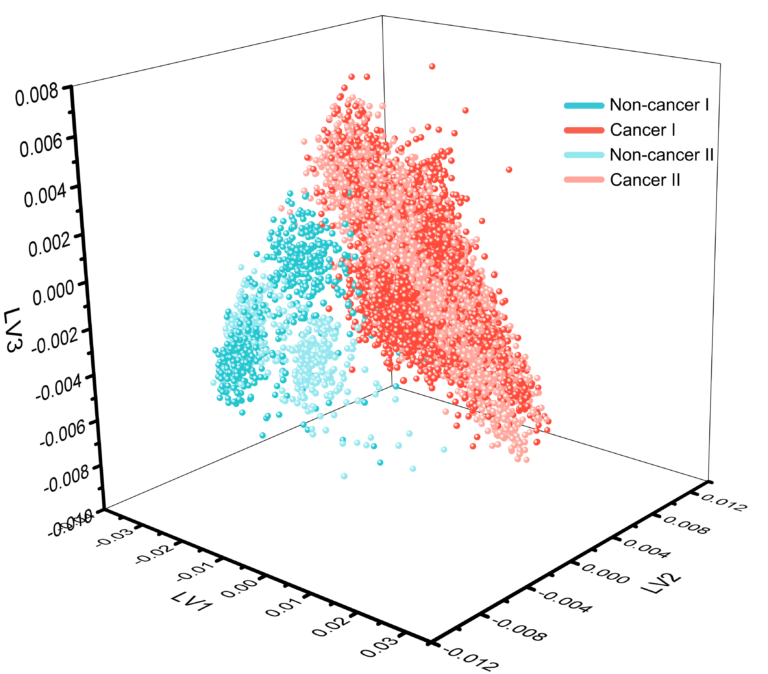
■細胞外小胞(EV)のラベルフリー解析
SPARTAは14,000を超えるEVを分析し、健常な乳房上皮細胞由来のEVと、乳がん細胞株由来のEVを区別することができました。がんと非がん細胞由来のEVとの95%以上の感度と特異性で達成されました。
Penders et al. ‘Single Particle Automated Raman Trapping Analysis of Breast Cancer Cell-Derived Extracellular Vesicles as Cancer Biomarkers.’ ACS Nano. 2021
こちらをお読みください