アプリケーション
フォトポレーションによるiPS細胞トランスフェクション
効率的で優しい非ウイルスエンジニアリング
フォトポレーションは新しく革新的な細胞内送達技術であり、レーザー光と光ナノ増感剤の組み合わせで 細胞膜に細孔を生成します。
既存技術の課題を克服する穏やかなトランスフェクション方法であり、細胞の品質を維持するダメージレスな方法であると共に、1回あたりの処理時間は30分未満とハイスループットです。
既存技術の課題を克服する革新的トランスフェクション
フォトポレーションは細胞へのダメージを最小限に抑えると同時に、
空間選択的かつ高スループットなトランスフェクションを実現しました。
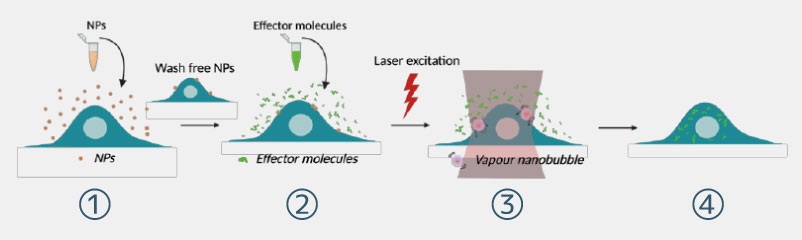
③レーザー光の照射によるトランスフェクション ④細胞は機能性を直ちに回復し、目的のiPS細胞が取得可能
技術概要:D10を用いたiPSCのAuNPフォトポレーション
- 60 nm のカチオン性金ナノ粒子 (PDDAC) をナノ増感剤として使用しました。
- 10kDa の FITC 標識デキストラン (FD10) をモデルカーゴ分子 (2 mg/mL) として使用しました。
- 送達効率と相対平均蛍光強度は、フローサイトメトリーを使用して定量化されました。
- 生存率は、代謝活性アッセイCellTiter-Gloを用いて測定しました。
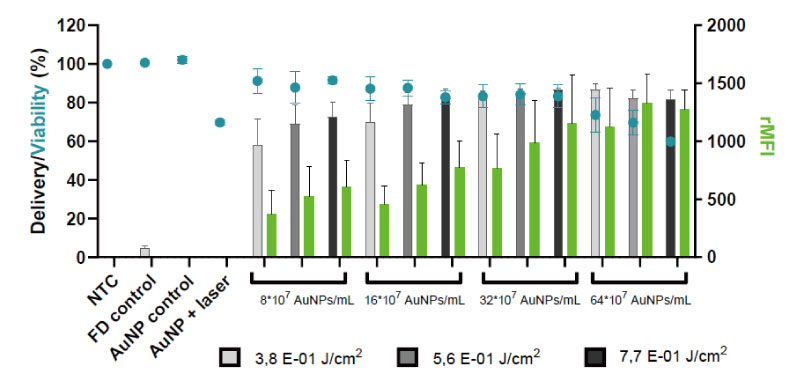
グレー軸:配信効率
緑軸:相対平均蛍光強度
青点:対応する代謝活性はCellTiter-Glo アッセイで測定されます。
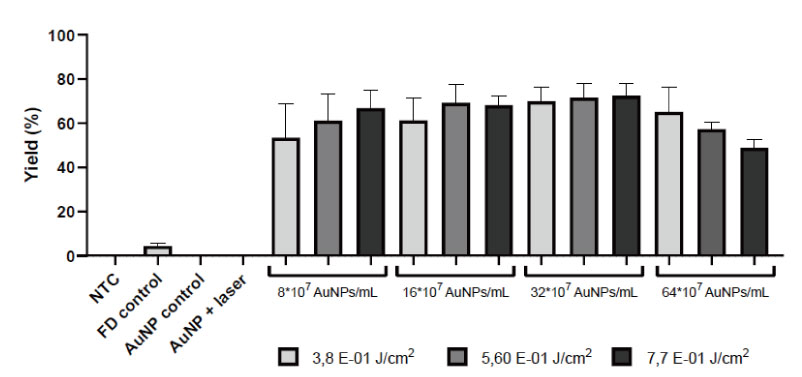
生存可能であり FD10 陽性である細胞の割合として定義されます。
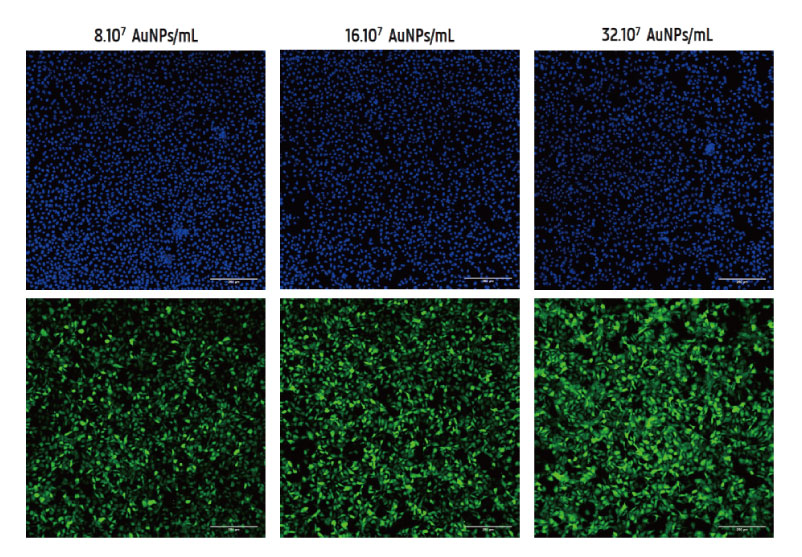
【上段】核が染色されました Hoechst 33342
増加する濃度の AuNP (左から右へ) を使用しました。
スケールバー: 250μm。
結果
AuNP フォトポレーションは、iPSC での高い生存率を維持しながら、高い送達率を達成できます。
この有望な物質をさらに発見するために、iPSC のトランスフェクション技術で他のカーゴ分子と光増感剤もテストされる予定です。
ウマやヒト由来の幹細胞へ高分⼦を効率的に送達
LumiPoreは幅広い種類のペイロードを、事実上あらゆる種類の細胞に導入することが可能です。このデータでは、ウマおよびヒト筋肉由来間葉系幹細胞へのトランスフェクション最適化として、サンプル毎にナノ増感剤の濃度とレーザーの照射エネルギー準位を変えることによる、細胞内への導入効率と生存率の評価を行いました。
細胞種にあわせたトランスフェクション
ウマ由来間葉系幹細胞(eMSCs)にFD10(FITC-デキストラン10kDa)をLumiPoreでトランスフェクションし、条件ごとの最適化を行い、
その後、得られた条件をもとにヒト由来間葉系幹細胞(hMSCs)にeGFP mRNAをトランスフェクションし、導入効率と細胞生存率を求めました。
細胞は事前にLumiSenseナノ感光剤を異なる濃度で導入され、LumiPoreよりエネルギー量の異なる条件(E3とE7)でのレーザー照射を受けました。 レーザー処理後に細胞のウォッシュを行い、フローサイトメトリ―で分析が行われました。
図1.ではFD10+細胞の割合(Efficiency %)ならびに細胞あたりのFD10量(rMFI:Ratio of Mean Fluorescence Intensity)はナノ感光剤の濃度増加に応じて向上しましたが、同時に生存率(処置2時間後のCellTitre-GloアッセイによるViability%)は徐々に減少しました。
この結果より、ウマ由来MSCsに対してナノ感光剤を250倍に薄めて添加し、LumiPoreの照射エネルギー準位をE7とした条件で約100%の導入成功率と86%の細胞生存率が得られました。
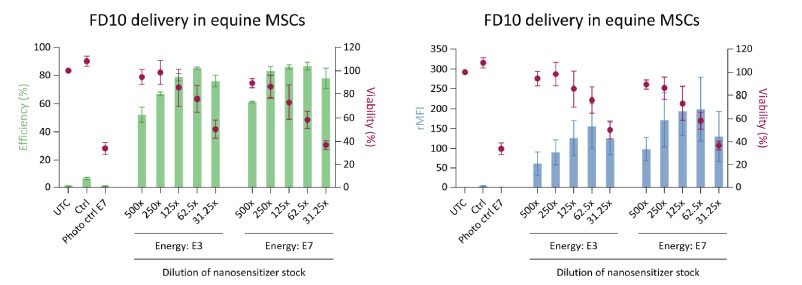
(左)ナノ感光剤濃度(ストックの希釈として表示)とFD10+ eMSCs(%)のパーセンテージは、フローサイトメトリ―により取得
(右)細胞毎のFD10蛍光強度(rMFI)は未処置の細胞と比較して計算
UTC:未処置, Ctrl:FD10添加のみ(LumiPore処理未実施), Photo ctrl E7: LumiPore処理のみ(FD10を添加未実施)
図2.では照射レーザー強度をE7として、各条件のFD10+細胞の割合(Efficiency %)ならびに細胞あたりのFD10量(rMFI:Ratio of Mean Fluorescence Intensity)の評価を行いました。
導入効率はナノ感光剤の濃度増加に応じて向上しましたが、同時に生存率(処置2時間後のCellTitre-GloアッセイによるViability%)が徐々に減少しています。このことから、ヒト由来細胞においてもナノ増感剤濃度を調節して導入効率と細胞生存率をコントロールできると考えられます。
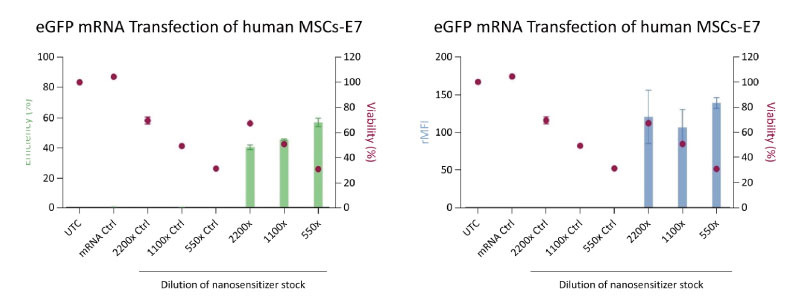
(左)ナノ増感剤濃度(試薬の希釈倍率として表示)とeGFP+ hMSCsの導入効率(Efficientry %)は、フローサイトメトリ―に取得
(右)細胞毎のeGFP蛍光含有量(rMFI)は未処置の細胞と比較して計算
結論
LumiPoreフォトポレーション遺伝子導入装置は、処理を行うサンプル毎にナノ増感剤の濃度とレーザーの照射エネルギー準位を変えることで細胞内への導入効率と生存率を最適化し、多種多様な細胞型とエフェクター分子におけるトランスフェクションを実現します。
フォトポレーション法によるインフラマソーム活性化研究
インフラマソームとは細胞ストレスや微生物感染に対抗する細胞内タンパク質複合体です。
このインフラマソーム活性化研究では、病原性因子をマクロファージや自然免疫細胞の細胞質に導入する必要がありますが、エレクトロポレーションなどの既存手法ではトランスフェクション工程による細胞毒性のほか、細胞機能やゲノムへの影響などの理由によりトランスフェクション自体が困難とされています。
LumiPoreによるフォトポレーション法は細胞へのダメージが少なく、高い送達性と細胞生存を可能にするため、マクロファージのようなトランスフェクションが困難な細胞種においても、インフラマソーム誘導タンパク質の細胞送達を行うことが可能です。
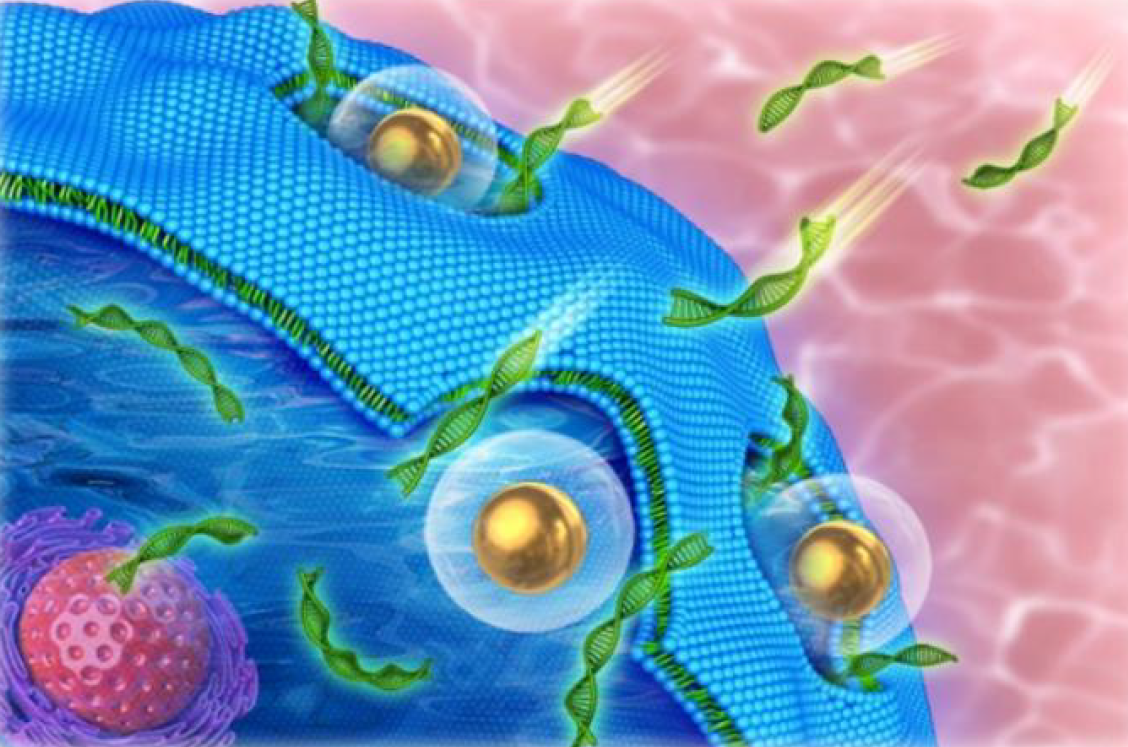
1.ナノ増感剤が細胞に吸着される
2.パルスレーザー照射によりナノ増感剤が細胞膜に孔を形成する
3.⾼分子が細胞質に通過し、細胞膜の孔が閉じる
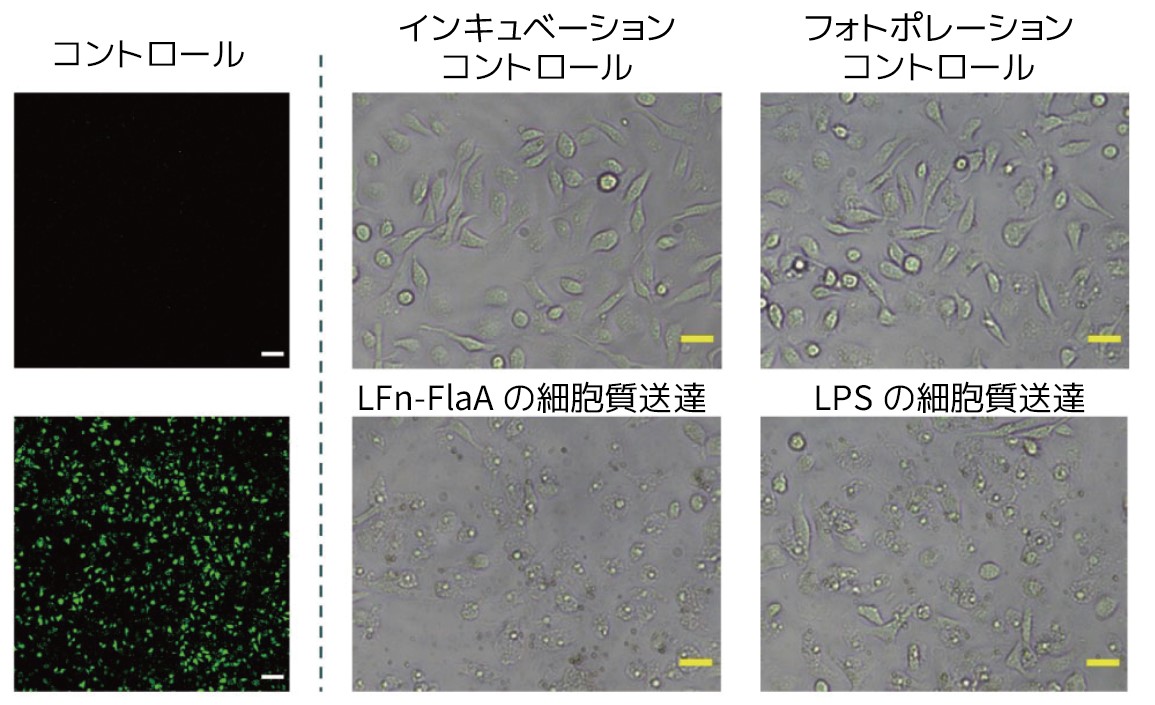
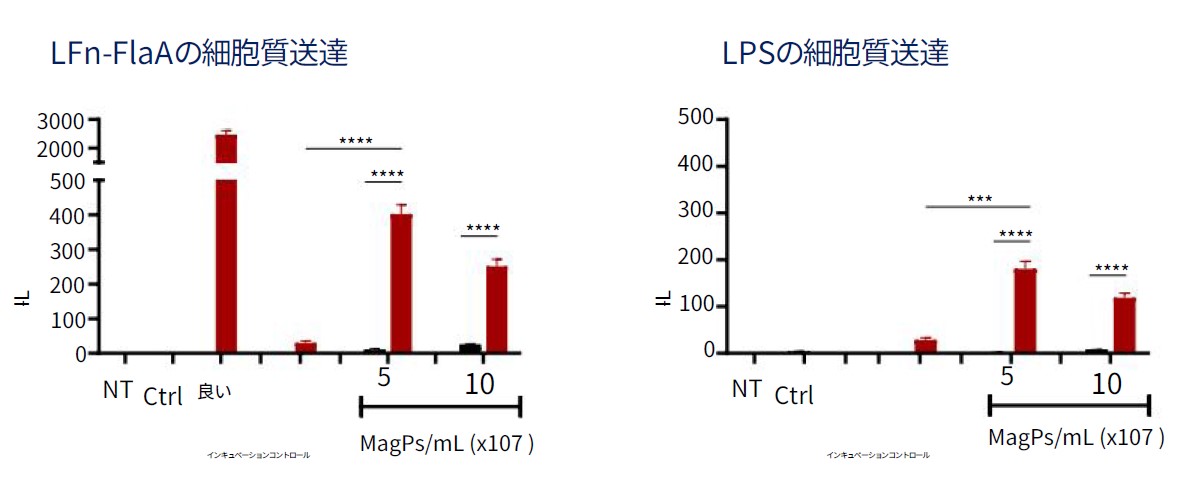
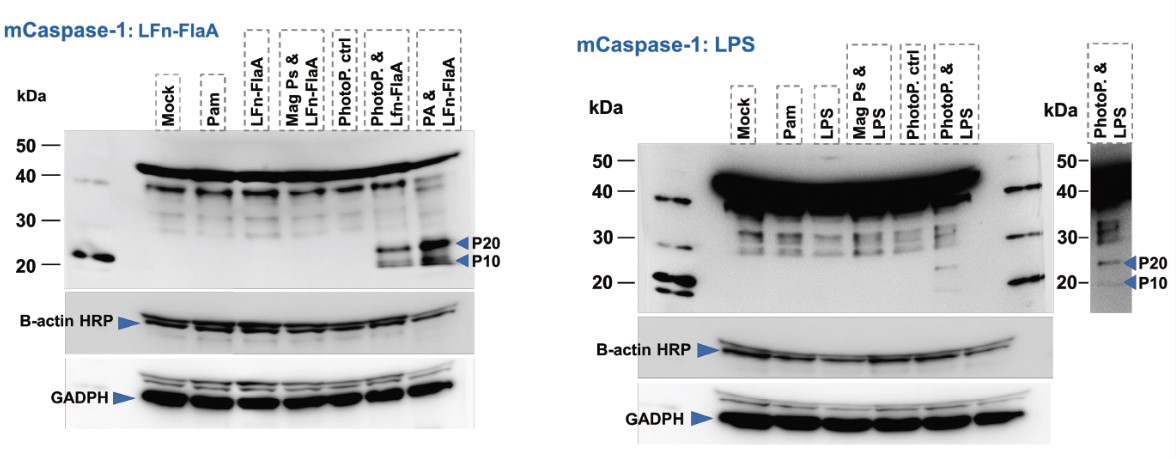
リポ多糖およびフラジェリンのサイトゾル送達
フォトポレーション法はナノ増感剤を利用した光による優しいトランスフェクション技術です。この手法はタンパク質性物質や非タンパク質性物質の両⽅を細胞内に送達できるため免疫応答の効率的な研究を可能にします。
このデータではリポ多糖(LSP:lipopolysaccharide)およびフラジェリン(LFn-FlaA:L. pneumophila flagellin)を原始マクロファージにトランスフェクションし、細胞における炎症応答を確認しています。
実験の結果、フォトポレーション法を使用した系列においてインフラマソームの活性が高まっています。
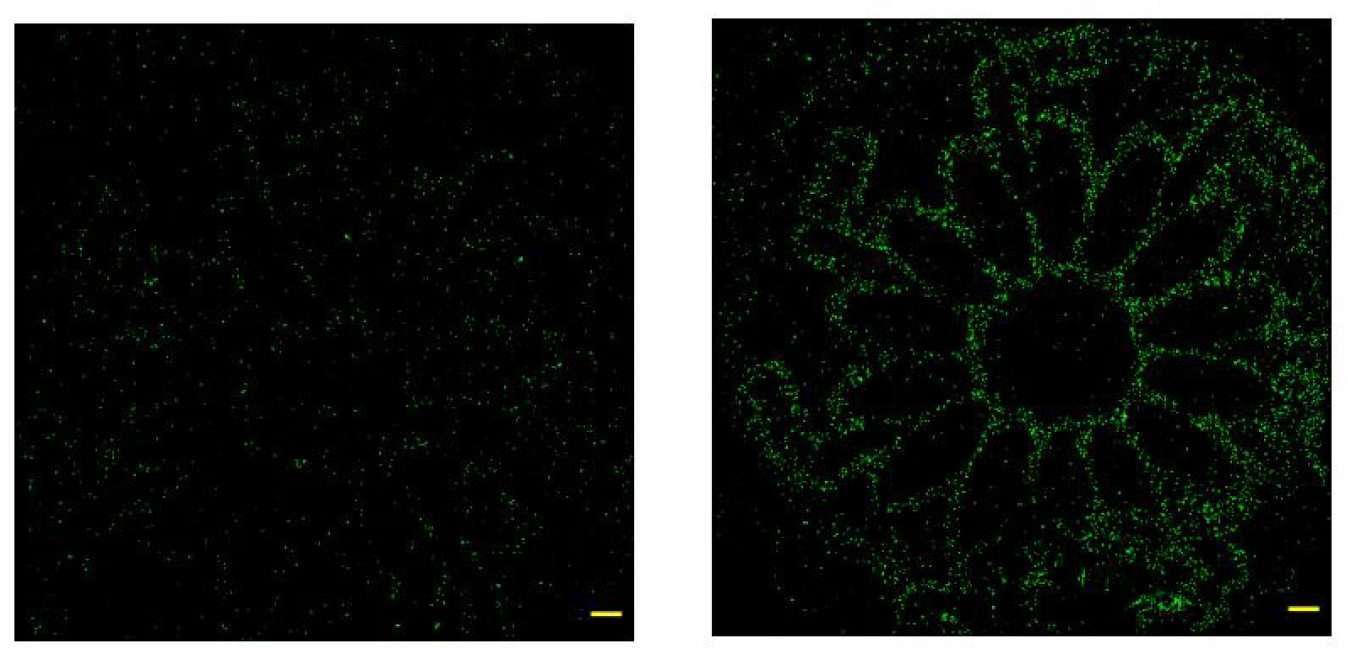
オプション機能:選択的なフォトポレーション
オプションの機能を使用することで、特定の領域に存在する細胞への選択的トランスフェクションが可能です。